Целевой участок в геноме для связывания двух молекул ПНК с образованием триплекса выбирается таким образом, чтобы он чуть-чуть перекрывался с участком связывания какой-нибудь рестриктазы. После связывания ПНК с ДНК препарат обрабатывается соответствующей рестриктазе метилазой. Метилаза метилирует все участки узнавания в геноме, кроме одного, который стал недоступен для связывания метилазы, так как его дуплексная структура была нарушена связыванием ПНК. Затем делается так, чтобы связывание ПНК с ДНК было разрушено. В результате единственное место связывания рестриктазы с ДНК восстанавливается, тогда как все остальные места связывания не работают, поскольку они прометилированы. Теперь рестриктаза разрежет ДНК только в одном месте, в том, которое было изначально выбрано для этой цели. Конечно, мы несколько утрировали ситуацию, неметилированных участков в геноме может оказаться несколько, но ясно, что такой подход должен резко увеличивать избирательность нуклеаз, что и было экспериментально продемонстрировано в моей лаборатории в Бостонском университете в работе, выполненной совместно с Нильсеном.
Все же подход, основанный на ПНК, оказался слишком сложным, и, что самое главное, его не удавалось использовать в живой клетке. А именно редактирование ДНК непосредственно в живой клетке представляет наибольший интерес. К началу 2010 года два очень изощренных биохимические метода специфического разрезания ДНК были разработаны в биотехнологических компаниях. И их уже стали применять для редактирования геномов. Но в начале 2013 года произошел подлинный прорыв, который самым радикальным образом изменил ситуацию. Появился метод, носящий неуклюжее название КРИСПР-кас.
Метод целиком базируется на системе приобретенного иммунитета у бактерий, о котором рассказано в главе 6.
Для редактирования генома действующие лица иммунной защиты бактерий, крРНК и кас-белок, переносят в эукариотическую клетку, при этом дизайн молекулы крРНК делается с таким расчетом, чтобы промежуточная последовательность в ней была идентична выбранному участку в геномной ДНК эукариотической клетки. «Как это можно?! – слышу изумленный возглас читателя. – Система произведет двунитевой разрыв в ДНК, на этом все и закончится: клетка погибнет». Нет, не закончится. Ведь недаром мы диплоидные существа: у каждого участка нашей аутосомной ДНК есть двойник, гомологичный участок, расположенный на сестринской хромосоме. Наличие гомологичного участка позволяет нашим соматическим клеткам залечивать или, как говорят, репарировать ДНК, которая подверглась самому опасному повреждению: двунитевому разрыву. Этот механизм репарации двунитевых разрывов называется гомологичной рекомбинацией. В деталях гомологичная рекомбинация – это сложный процесс, и он происходит не только при репарации, но и в других случаях.
Для нас важно следующее: для того чтобы гомологичная рекомбинация репарировала двунитевой разрыв, необходимо, чтобы в клетки находилась ДНК с двумя последовательностями, идентичными двум последовательностям, расположенным справа и слава от места разрыва. Бактериальная ДНК гораздо более уязвима в отношении двунитевых разрывов именно потому, что бактерии – это гаплоидные существа, у них имеется только одна-единственная копия генома, и поэтому никакая гомологичная рекомбинация невозможна. Именно гомологическая рекомбинация не только спасает эукариотическую клетку от гибели, когда в клетку вводят крРНК и кас-белок, но и позволяет осуществить редактирование генома. Как это делается?
Давайте разберем ситуацию на конкретном примере. Представим себе, что мы решили осуществить генную терапию больного серповидно-клеточной анемией (СКА), о которой шла речь в главе 2 (и еще пойдет в главе 12). Иными словами, мы хотим заменить мутантный ген у больного на здоровый ген β-цепи гемоглобина, не несущий мутацию СКА (рис. 46). Используя генную инженерию, мы готовим вектор, которым может быть плазмида или ДНК обезвреженного аденовируса. В вектор мы встраиваем следующие добавочные участки: два участка, кодирующие две молекулы крРНК, причем дизайн одной сделан так, чтобы она вызывала разрыв около левого края гена СКА, а дизайн другой сделан так, чтобы разрыв был около правого края; ген, кодирующий кас-белок. Мы размножаем взятые из пациента клетки – предшественницы красных кровяных клеток и вводим в них наш вектор, а также отрезок двунитевой ДНК, состоящий из здорового гена β-цепи гемоглобина, не несущего мутации СКА, слева и справа от которого имеются точно такие же последовательности (они обозначены как ГЛ и ГП на рис. 46), как последовательности слева и справа от двунитевого разрыва в геномной ДНК, который получится после удаления из генома гена СКА с помощью двух молекул крРНК, которые закодированы в векторе.
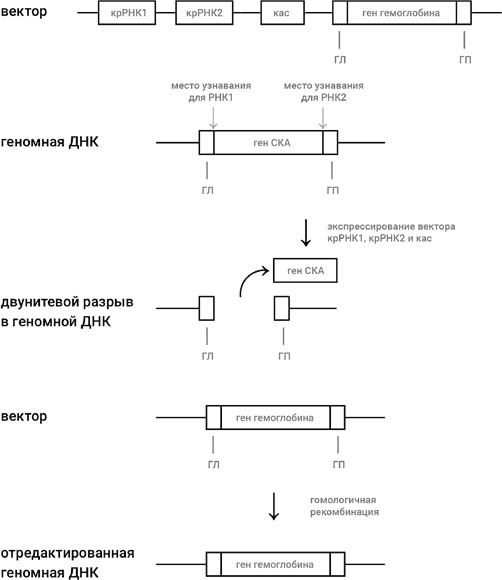
Рис. 46. Редактирование генома при помощи технологии КРИСПР-кас. Стандартными методами генной инженерии создается вектор (плазмида или обезвреженный аденовирус), в который включены гены, кодирующие две крРНК, узнающие левый и правый концы гена, который будет заменен (в нашем случае это ген СКА), ген кас и ген, на который мы хотим заменить ген СКА, т. е. в нашем случае – нормальный ген β-цепи гемоглобина. Слева и справа от гена β-цепи гемоглобина должны быть участки, гомологичные (т. е. идентичные) тем участкам, которые соседствуют с ним (а также с геном СКА) в геноме (они обозначены как ГЛ и ГП). Введение – вектора в клетку – предшественницу красных кровяных шариков приводит к экспрессии крРНК1, крРНК2 и кас-белка, что в свою очередь приводит к выбрасыванию гена СКА из генома и к двунитевому разрыву в ДНК, как было объяснено в главе 6 (см. рис. 25). В клетке – предшественнице красных кровяных шариков включается система репарации двунитевого разрыва, называемая «гомологичной рекомбинацией». Наличие участков ГЛ и ГП в векторе (или в отдельно введенном отрезке ДНК, несущем здоровый ген) приводит к тому, что ген β-цепи гемоглобина переносится из вектора в образовавшуюся брешь – замена мутантного гена СКА на здоровый ген β-цепи гемоглобина совершена
Надо только, чтобы вектор и ДНК, несущая здоровый ген, проникли в клеточное ядро, дальше все происходит само собой. Транскрибируются две молекулы крРНК и мРНК кас-белка, которая транслируется в цитоплазме, и кас-белок проникает назад в ядро. Система крРНК и кас-белка вырезает мутантный ген из генома, а репарирующая система в процессе залечивания двунитевого разрыва использует для гомологичной рекомбинации введенную ДНК, несущую здоровый ген β-цепи гемоглобина. В результате происходит то, что мы хотели: мутантный ген заменен на здоровый (рис. 46). Осталось только вернуть отредактированные клетки назад в организм пациента, чтобы они стали производить красные кровяные клетки, содержащие нормальный, здоровый гемоглобин.
Технология редактирования генома с помощью КРИСПР-кас, как обычно обозначается описанная методика, обладает громадными преимуществами по сравнению с генной инженерией, о которой речь шла выше в этой главе, и по сравнению с другими методами редактирования генома. Главное, что эта технология позволяет резать и сшивать ДНК внутри живой клетки, причем делать это довольно просто и дешево. Конечно, имеются свои проблемы, главная из которых – это доставка в клеточное ядро крРНК и кас-белка или векторов, которые их экспрессируют. Имеется несколько способов такой доставки, но все они далеко не идеальны. Конечно, были бы гораздо лучше, если бы аналог кас-белка существовал в эукариотической клетке и требовалось бы только доставить крРНК, подобно тому, как в случае системы РНК-интерференции нужно доставить только киРНК (см. главу 12). Но пока что такие поиски не привели к успеху, и надо довольствоваться тем, что имеется, а это уже очень много.



