Эта история началась в один уик-энд летом 2009 года, когда Говард Джейкоб, генетик из Медицинского колледжа штата Висконсин, открыл электронное письмо от коллеги-врача, в котором тот в душераздирающих тонах изложил просьбу храброго четырехлетнего мальчика. Врачи, наблюдавшие и лечившие маленького Ника, никак не могли диагностировать, чем же он болен, – подозревали аутоиммунное заболевание, медленно сжирающее его пищеварительный тракт. Ник перенес больше сотни операций – врачи тщетно пытались залатать дыры у него в кишках. Большую часть времени из четырех лет своей жизни он провел в детской больнице.
В письме, открытом на экране компьютера у Джейкоба, был единственный вопрос: если отсеквенировать геном Ника – появится ли шанс обнаружить генетическую подоплеку болезни мальчика в том случае, если дело действительно в генах? В лаборатории Джейкоба ставили эксперименты на крысах, а не на людях, но он ждал подходящего момента, чтобы опробовать клиническое секвенирование генома. В данном случае представилась отличная возможность. Что, если странное заболевание Ника в мельчайших подробностях прослеживается в его генетическом коде? Однако в то время врачи могли лишь предложить тестировать подозрительные гены по одному. Джейкоб сознавал, что для поиска истины, которая помогли бы завершить генетическую одиссею Ника (так он ее называл), врачи должны были провести полномасштабный поиск: секвенировать геном ребенка и систематически отсеивать все варианты ДНК, пока наконец не выявят тот, из-за которого болеет Ник.
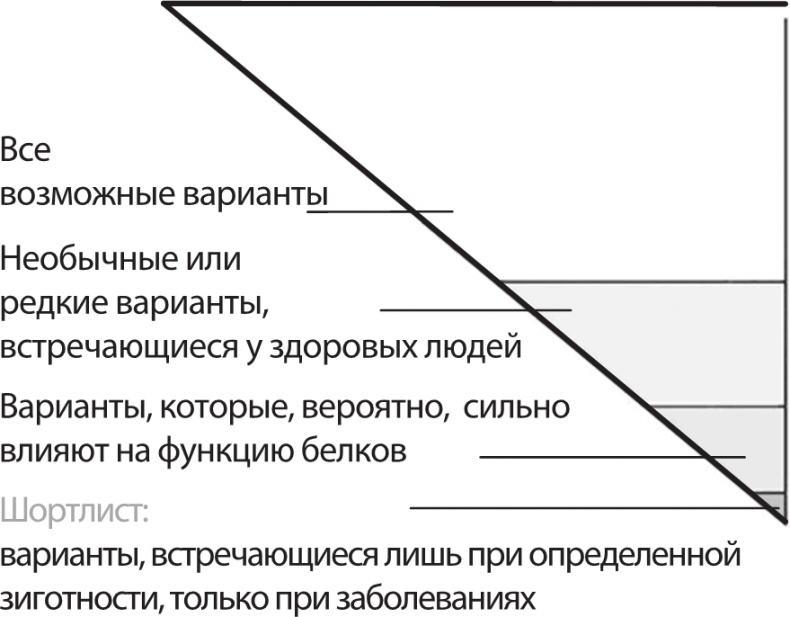
Иголка в стоге сена: чтобы вычленить редкую разрушительную мутацию из пула с тысячами потенциальных вариантов ДНК в геноме пациента, исследователи сужают поле поиска, отсеивая такие изменения последовательностей, которые сравнительно широко распространены, либо те мутации, которые, скорее всего, не будут влиять на функцию белков. Таким образом, список «подозрительных» мутаций иногда сужается менее чем до десяти
Еще в 2009–2010 годах стоимость полного секвенирования генома оставалась запредельно высокой, поэтому команда Джейкоба, сотрудничавшая с Life Sciences, пошла на хитрость, секвенировав экзом Ника, то есть 2–3 % генома, на которые приходится около 20 тысяч генов, и наудачу предположив, что мутация не затеряна в куче некодирующей «мусорной» ДНК. Одна из коллег Джейкоба, шотландский биоинформатик Лиз Уортисоставила список примерно из двух тысяч потенциально подозрительных генов – это целых 10 % генетического багажа человека.
Никаких особенных мутаций там не обнаружилось. Но Лиз обратила внимание на ген XIAP, находящийся в X-хромосоме. У Ника на этом участке оказался такой вариант последовательности, который явно указывал на редкое генетическое заболевание, именуемое «X-сцепленный лимфопрофилеративный синдром второго типа», разрушающий нормальную работу иммунной системы. Команда из Висконсина догадалась, «откуда ветер дует»: нужно было срочно действовать, ведь теперь лечащие врачи Ника имели все основания назначить ему трансплантацию костного мозга.
Эпопея Ника была изложена в виде серии статей в Milwaukee Journal Sentinel, удостоенной Пулитцеровской премии, а затем в книге One in a billion («Один на миллиард»), написанной теми же авторами. После успешной трансплантации Ник впервые в жизни смог с удовольствием отметить Хэллоуин, попробовать твердую пищу и даже пошел в школу. Увы, невзгоды Ника пока не закончились: он стал страдать настолько частыми приступами эпилепсии, что вынужден был носить защитный шлем. Родители Ника обратились в Законодательное собрание штата Висконсин с просьбой разрешить мальчику принимать ограниченные дозы марихуаны, которая помогает от эпилепсии. Все-таки для Ника это был огромный прогресс. Выражение «конец диагностической одиссеи» стало ассоциироваться прежде всего с тем подходом, который впервые опробовали Джейкоб с коллегами. Это и неудивительно: сегодня стоимость полного секвенирования генома пациента составляет от двух до трех тысяч долларов, что, по иронии судьбы, даже меньше платежей, взимаемых за секвенирование единственного ракового гена, запатентованного некоторыми компаниями, такими как, например, Myriad Genetics, контролирующая проведение теста BRACAnalysis.
После того как генетики, выступив в роли сыщиков, смогли идентифицировать характерные для ряда заболеваний мутации, многие дети повторили путь Ника; в некоторых случаях (но пока их очень мало) удалось достичь весьма примечательных результатов. Так, близнецы, дети Ретты и Джо Берри, с раннего детства страдали неврологическими расстройствами. Им было выставлено огромное количество крайне противоречивых диагнозов, в том числе судорожная параплегия. Лечение нейрохимическим препаратом L-диоксифенилаланином ненадолго давало положительный эффект, но затем маленькой Алексис снова становилось хуже. К счастью, Джо Берри, отец детей, работал главным системным администратором в Life Technologies, поэтому у него были полезные связи, позволившие провести секвенирование. Когда коллеги секвенировали ДНК его детей, там обнаружилась редкая мутация, указывающая на синдром Сегавы. Достаточно было дополнить L-диоксифенилаланин селективным ингибитором обратного захвата серотонина (это очень распространенное и доступное лекарство) – и близнецы практически полностью выздоровели.
Многие дети избежали диагностических одиссей с тех пор, как история Ника Волкера попала на первые полосы газет. Это были Лилли Гроссман из Ла-Хольи, штат Калифорния; Джейкоб и Дилан Эллингемы из Сакраменто, храбрый Шелби Вейлинт из Финикса, штат Аризона (Шелби теперь может ходить благодаря тому, что удалось открыть критическую ошибку в его гене, отвечающем за синтез дофамина). Когда Кэт Браунстейн и ее коллеги из детской больницы Бостона устроили соревнование между тридцатью командами, которым было поручено идентифицировать мутации у трех пациентов, одна мама, узнавшая, что мышечное расстройство у ее сына обусловлено мутацией в гигантском гене титина, едва сдерживала слезы, когда благодарила ученых. Ее сын одиннадцать лет блуждал по медицинским лабиринтам, и вот эта история закончилась постановкой диагноза.
В настоящее время все больше и больше медицинских центров предлагают те или иные варианты клинического генетического секвенирования. В детской больнице города Мэдисон, штат Висконсин, врачи ежемесячно проводят встречи, на которых представляют и обсуждают пациентов-кандидатов, которым безотлагательно требуется полное секвенирование генома. Ни в одном другом медицинском центре не изучили столько полных геномов пациентов, сколько в Бэйлорском медицинском колледже, город Хьюстон. Кристин Энг с коллегами секвенировали ДНК двух тысяч пациентов; при этом в 25 % случаев удалось верифицировать диагноз. Аналогичные показатели успешной диагностики наблюдаются и в большинстве других центров, в частности у группы Джейкоба, открывшей специализированный центр клинической геномики в Хантсвилле, штат Алабама. По мере того как медицинская польза от клинического секвенирования генома становится все очевиднее, страховые компании также стараются на этом зарабатывать: зачастую все затраты на секвенирование генома возмещаются, хотя такую работу можно сравнить просто с высокотехнологичным походом на рыбалку.



