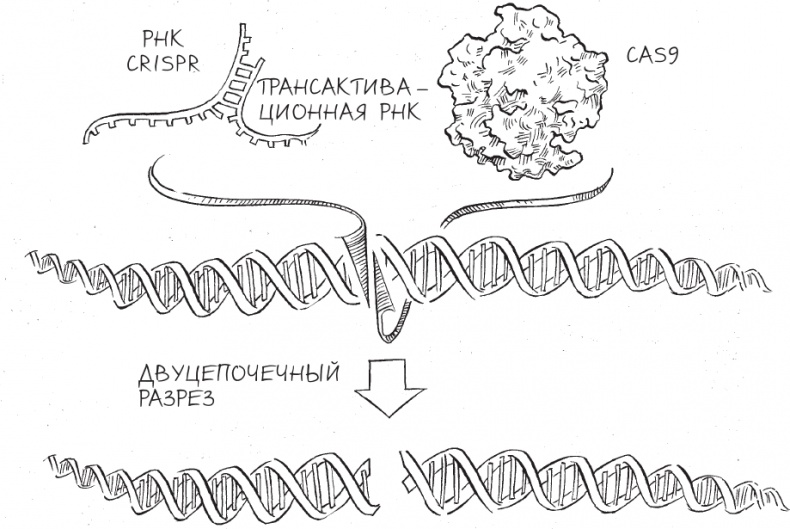
В конце концов Кшиштоф и Мартин провели опыты, где они использовали не только РНК CRISPR, но и второй тип РНК, названный трансактивационной РНК (tracrRNA), который, как обнаружили в лаборатории Эммануэль, был необходим для выработки РНК CRISPR у S. pyogenes. Результат оказался простым, однако он очень много значил для нас: ДНК, в которой 20 “букв” точно совпадали с эквивалентами в молекуле РНК CRISPR, была аккуратно вырезана. Контрольные эксперименты показали, что совпадение последовательностей РНК CRISPR и ДНК необходимо – как и присутствие белка Cas9 и трансактивационной РНК.
В сущности, эти результаты моделировали то, что происходит в клетке во время иммунного ответа CRISPR с минимальным набором компонентов; никаких клеточных молекул, помимо Cas9 и двух молекул РНК, которые выглядели так же, как они выглядят внутри клетки Streptococcus pyogenes. Плюс еще молекула ДНК с такой же последовательностью, как в геноме фага. Более важным казался тот факт, что двадцать этих “букв” ДНК совпадают с “буквами” РНК CRISPR, – это означало, что РНК CRISPR и одна из двух нитей ДНК способны образовать свою собственную двойную спираль путем комплементарного взаимодействия оснований. Такая двойная спираль ДНК – РНК могла быть ключом к специфичности активности Cas9, связанной с разрезанием ДНК.
Наблюдение за реакцией разрезания ДНК в пробирке требовало высокоточного метода регистрации, поскольку увидеть непосредственно факт разрезания ДНК невозможно. Двойная спираль ДНК в 50 “букв” имеет длину всего 17 нанометров, или 17 миллиардных частей метра, а это приблизительно одна тысячная толщины человеческого волоса. Даже самый мощный микроскоп неспособен нам этого показать, поэтому Мартин и Кшиштоф использовали два любимых инструмента биохимиков, изучающих нуклеиновые кислоты: радиоактивный фосфор и гель-электрофорез. В новых опытах к концам молекул ДНК с помощью химических реакций присоединялись атомы радиоактивного фосфора, и в результате эти молекулы начинали светиться на рентгеночувствительной пленке. Затем электрический ток высокого напряжения прогонял все эти молекулы ДНК через большой брусок желеобразного материала, который работал как молекулярное сито, сортирующее молекулы по размеру. После просвечивания геля рентгеновским излучением на нем становились видны участки (полосы) сигнала, в том случае если ДНК была разрезана Cas9: одна полоса от полноразмерной ДНК и другая – от ДНК, поделенной на два фрагмента.
Cas9 разрезает молекулу ДНК на два фрагмента
В дальнейшем Мартин показал, что обе нити ДНК разрезаются белком Cas9 в одном и том же месте относительно РНК CRISPR. Что важно, РНК CRISPR и молекулы трансактивационной РНК оставались неизменными на протяжении эксперимента и потому могли быть использованы белком Cas9 повторно для определения последовательности ДНК, подлежащей разрезанию.
Проанализировав эти результаты, мы поняли, что у нас есть ключевые компоненты машины, разрезающей ДНК, – механизма, позволяющего S. pyogenes и S. thermophilus (и любой другой бактерии со сходным типом системы CRISPR) не только находить определенные последовательности ДНК фагов, но и уничтожать их. Необходимыми компонентами для разрезания ДНК были фермент Cas9, РНК CRISPR и трансактивационная РНК.
Я ликовала, когда мы получили эти результаты, но при этом меня волновало множество новых вопросов, ответы на которые нам хотелось узнать как можно скорее. Чтобы понять, за счет чего конкретно фермент Cas9 способен разрезать ДНК “по наводке” РНК, нам нужно было определить, какой участок белка обеспечивает его режущую функцию. Чтобы доказать, что разрезание ДНК специфично и требует совпадения между РНК CRISPR и последовательностью ДНК, нам нужно было изменять последовательность ДНК “буква” за “буквой” и показать, что разрезания не происходит, если последовательности РНК и ДНК совпадают не полностью. А чтобы выявить, каким образом работают молекулы РНК CRISPR и трансактивационной РНК, нам предстояло методически убирать разные фрагменты каждой из молекул и определять, без каких из них невозможно обойтись.
Мартин и Кшиштоф работали над решением этих вопросов не покладая рук, и вскоре стала вырисовываться удивительная картина: Cas9 может присоединяться к двойной спирали ДНК, разделять две нити для формирования новой спирали между РНК CRISPR и одной из нитей ДНК, а затем использовать две структуры с нуклеазной активностью, чтобы одновременно разрезать обе нити ДНК, создавая двуцепочечный разрыв. В зависимости от последовательности связанной с ним молекулы РНК Cas9 нацеливается практически на любую произвольную последовательность ДНК и разрезает ее. По сути, молекула РНК CRISPR действует подобно набору GPS-координат, точно наводя Cas9 на нужное место в длинной молекуле ДНК в соответствии с совпадением “букв” РНК CRISPR и ДНК. Это по-настоящему программируемая нуклеаза, которая могла бы нацеливаться на любую произвольную последовательность ДНК, используя все те же правила спаривания оснований – А с Т, Г с Ц и так далее. Для любой двадцатибуквенной последовательности, которую содержит РНК-проводник, Cas9 находит подходящую пару в ДНК и затем разрезает ее.
Функция Cas9 в битве между бактериями и вирусами теперь казалась совершенно объяснимой. Снабженный запасом молекул РНК, взятых из массива CRISPR, в котором были собраны кусочки ДНК фагов, Cas9 можно мгновенно перепрограммировать на разрезание соответствующих участков вирусных геномов. Он оказался совершенным бактериальным оружием: снаряд, который умеет находить вирусы, а потом поражать цель – быстро и с невероятной точностью.
Получив результаты работы Мартина и Кшиштофа, мы были готовы заняться следующим вопросом: если бактерия могла запрограммировать Cas9 на разрезание специфических последовательностей ДНК вирусов, можем ли мы, как и предполагали раньше, запрограммировать Cas9 на разрезание других последовательностей ДНК, не обязательно вирусных? Мы с Мартином были хорошо осведомлены о достижениях в области редактирования генома и о возможных перспективах – а также существенных ограничениях – программируемых нуклеаз на основе ZFN и TALEN. Мы осознавали – и были поражены этим, – что обнаружили систему, на основе которой можно построить самый простой метод редактирования генома из всех, что были открыты и разработаны до сих пор.
Но чтобы превратить эту крошечную молекулярную машину в мощный инструмент редактирования генома, предстояло сделать еще один шаг. К тому времени мы уже разобрали сложный иммунный ответ на простые части, которые можно разделять, изменять и комбинировать по-разному. Более того, тщательно проведя биохимические эксперименты, мы установили молекулярные правила, управляющие функциями этих различных частей. Теперь же мы хотели удостовериться, что можем видоизменять Cas9 и молекулы РНК для нацеливания на любую выбранную последовательность ДНК и для ее уничтожения. Если сможем – значит, CRISPR поистине мощный инструмент.
Процесс программирования машины CRISPR-Cas9 на самом деле состоял из двух этапов: из проработки идеи и собственно эксперимента. Сначала, конечно, идея. Мартин со своей обычной дотошностью методично модифицировал обе молекулы РНК – молекулу РНК CRISPR, отвечающую за наведение на цель, и молекулу трансактивационной РНК, которая удерживает вместе молекулы РНК CRISPR и Cas9 (с тем чтобы определить, каким образом каждая “буква” каждой РНК влияет на ее функции). На основе этой информации мы с Мартином придумали способ слить две молекулы РНК в одну. Если соединить конец одной молекулы с началом другой, то итоговая гибридная РНК – если она вообще окажется работоспособной – поможет нам упростить машину для нарезки ДНК, которую мы программируем: нам не придется добавлять к Cas9 две молекулы РНК – гида (РНК CRISPR) и помощника (трансактивационную РНК). Вместо этого мы сможем использовать фермент в сцепке с единственной молекулой РНК – РНК-гидом, который выполнял бы обе задачи. Снижение сложности системы сильно повысило бы удобство ее применения.



