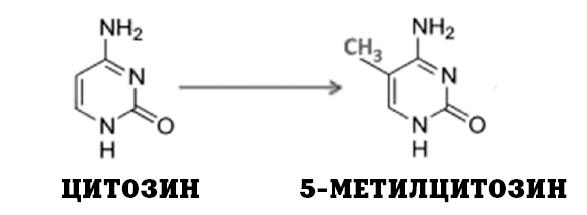
Выше мы с вами говорили о промоторах – «стартовых площадках» на молекуле ДНК, откуда начинается считывание генетических кодов. Так вот, метилирование цитозина на промоторном участке препятствует считыванию информации с данного гена. Метильная группа «портит» стартовую площадку и делает ген неактивным до тех пор, пока под действием ферментов-деметилаз не произойдет обратный процесс – деметелирование цитозина (удаление метиловой группы). Проще говоря, когда ген перестает быть нужным, на него вешают метиловый «замок», а как только ген понадобится, «замок» снимают. Все просто и эффективно.
Примерно один процент наших генов постоянно блокирован посредством метилирования цитозина на промоторах. Общее суммарное количество метилированного цитозина в нашей ДНК составляет примерно 5 %.
Все эпигенетические методы в той или иной степени участвуют в процессе старения, ведь регуляция экспрессии генов является важной составной частью этого процесса. Теоретически (пока что теоретически, но от теории до практики, как известно, всего один шаг) можно замедлять старение организма, «включая» деактивированные гены. Точно так же управление метилированием ДНК может предотвращать развитие многих заболеваний или излечивать их. Так, например, деактивация генов KLF14, FHL2 и GNPNAT1 значительно снижает риск развития сахарного диабета второго типа
[55]. Метилирование ДНК представляет собой относительно простой процесс, и управлять им несложно, так что перспективы перед лечебным метилированием, как и перед всей медицинской генетикой, открываются широчайшие. В идеале, до которого наука когда-нибудь дойдет, профилактика всех заболеваний будет осуществляться еще во внутриутробном периоде путем подавления или же активации определенных генов.
Третий метод эпигенетического управления – это модификация гистонов. Гистонами называются ядерные белки, участвующие в упаковке молекул ДНК и в эпигенетической регуляции таких процессов, как транскрипция, репликация и репарация.
О транскрипции и репликации мы с вами уже говорили, а вот о репарации нет. Пора исправить это упущение. Репарацией
[56] называется процесс ликвидации повреждений в молекулах ДНК, возникающих на протяжении жизни клетки. Если парочка атомов случайно отщепилась, или, скажем, произошел разрыв молекулы, то гистоны сразу же начинают ремонтные работы.
Терминальная, то есть концевая часть гистона представляет собой условный паспорт белка, его индивидуальный код, записанный сочетанием определенных аминокислот. Изменяя этот код, можно влиять на все процессы, происходящие с участием гистонов, начиная от упаковки молекул ДНК в хроматин и заканчивая… А вот где заканчиваются полномочия гистонов, пока еще не ясно. Их детальным изучением ученые занялись примерно два десятка лет назад, а с научной точки зрения это весьма маленький срок, особенно в такой «кропотливой» науке, как генетика. Не исключено, что в итоге гистоны окажутся в ответе за все-все-все, что происходит с ДНК и РНК. Во всяком случае, способность некоторых гистонов повышать вероятность метилирования ДНК уже доказана.
Как можно изменить код гистона?
Например, посредством уже известного вам метилирования одной из аминокислот, образующих код. Или же посредством ацетилирования, при котором один атом водорода в молекуле органического соединения замещается ацетильной группой [-CH3CO]. Или же посредством фосфорилирования, при котором в молекулу включается остаток ортофосфорной (фосфорной) кислоты [-РО4]. Не столь важно, какой именно остаток присоединяется к концевой части гистона. Важно то, к какой именно аминокислоте
[57] он присоединяется. Проще говоря, модель замка, который вешается на аминокислоту, не имеет значения, главное, чтобы замок был повешен в нужном месте.
Ассортимент РНК состоит из молекул разных размеров – от гигантов-матриц до крошечных «лилипутов», образованных двумя десятками нуклеотидов. Однако это тот самый случай, когда можно сказать: «мал, да удал». МикроРНК участвуют в эпигенетической регуляции экспрессии генов, влияя на стабильность матричных РНК и, соответственно, на процесс трансляции белков на этих матрицах. У каждой молекулы матричной РНК в конце кода (то есть не на «головном», а на «хвостовом» участке) находится своеобразная «болевая точка» – некодирующий участок. Удар по этой точке, то есть прикрепление микроРНК к некодирующему участку, блокирует матрицу или же вызывает ее разрушение. Ген пребывает в целости и сохранности, а белок, который этот ген кодирует, в клетке не образуется, потому что для него нет матриц! Этот механизм называется РНК-интерференцией
[58].
Знаете ли вы, что такое прион?
Если вы не сумели ответить на этот вопрос, то не спешите огорчаться. О существовании прионов, кроме биологов, мало кто знает. А вот о «коровьем бешенстве», пожалуй, слышали все.
Возбудителем «коровьего бешенства», которое по-научному называется губчатой энцефалопатией крупного рогатого скота, а также возбудителем болезни Крейтцфельдта – Якоба, возникающей после употребления зараженной говядины у людей, является прион – инфекционный агент белковой природы.
Прионы представляют собой белки с аномальной структурой. Соединяясь с гомологичным, то есть схожим, нормальным клеточным белком, прион изменяет его структуру, превращая нормальный белок в аномальный, в свое подобие. Размножение прионов отчасти напоминает размножение вирусов, поскольку и те, и другие могут размножаться только внутри клетки-хозяина, используя ее ресурсы. Только вирус содержит генетический материал – нуклеиновую кислоту, а прион не содержит. Прион прост настолько, что проще уже некуда. Это белковая молекула, всего лишь молекула и ничего больше.
«Лакомством» для прионов служат нервные клетки, особенно клетки головного мозга. По каким-то неведомым пока еще причинам прионы предпочитают эти клетки всем прочим. Поэтому у человека и ряда других млекопитающих прионы вызывают энцефалопатию – поражение головного мозга.



