Этот план, конечно же, имеет отношение к растворимости, и выясняется, что растворимость – это общая проблема молекул лекарств, то есть фармакологически активных соединений. Хотя сегодня фармацевты и не используют стрихнин, он служит хорошим примером. Как и многие чрезвычайно ядовитые вещества, стрихнин встречается в природе: его можно экстрагировать из дерева под названием «рвотный орех» (Strychnos nuxvomica), произрастающего в Индии
[176]. Однако такой экстракт абсолютно бесполезен для приготовления «тонизирующих средств», поскольку эти жиролюбивые молекулы совершенно не растворяются в воде; этой чертой обладают многие активные компоненты лекарств.
Взгляните на рисунок 30 – и вы увидите, что в структуре стрихнина преобладают связи углерод – водород и углерод – углерод. Все они характеризуются более или менее симметричным распределением электронных пар между атомами; дело обстоит иначе в молекуле воды, где жадный атом кислорода держит поближе к телу два электрона, которые он официально должен делить с водородом, что сообщает атомам кислорода однозначный отрицательный заряд, а атомам водорода – положительный заряд. Мы называем молекулу воды полярной, потому что у нее есть два конца с заметными по величине и однозначно расположенными зарядами, а вот молекула стрихнина неполярна, потому что в ее структуре нет подобных центров с заметным зарядом.
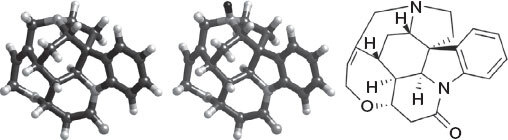
Рисунок 30. Слева: молекула стрихнина, нерастворимая в воде. В центре: молекула стрихнина, проявившая свойства основания и принявшая протон (Н+, черного цвета) от молекулы хлороводорода (HCl) с образованием соли (стрихнин Н+)(Cl—), известной как гидрохлорид стрихнина и растворимой в воде
[177]. Справа: палочковая схема строения стрихнина.
Еще одно базовое эмпирическое правило, обычно усваиваемое начинающим химиком, гласит, что «подобное растворяется в подобном», – возможно, он или она уже усвоили это на собственной кухне. У столовой соли очень полярное строение, и в растворе она распадается на катионы натрия (Na+) и отрицательно заряженные анионы хлора (Cl—); и те и другие любят поплескаться и поиграть с полярными молекулами воды. С другой стороны, многие ароматические и вкусовые молекулы предпочитают жиры и плохо растворяются в воде. Вот почему небольшое количество сливок или растительного масла усиливает вкус многих блюд: эти чудесные молекулы растворяются в жире и легко переносятся к нашим органам обоняния. Более того, если вы увлекаетесь диетами, вам следует знать, что то же самое касается и некоторых витаминов, особенно витамина А: они также растворяются в жирах, так что добавить в морковь сливочное или оливковое масло – не такая уж плохая идея.
На молекулярном уровне мы грубо подразделяем наши вещества на полярные и неполярные; неполярные вещества не растворяются в таких полярных растворителях, как вода. Возьмем для сравнения поверхность липучки «велкро» или фетра и ровную стеклянную поверхность. Фетр прилипает к фетру, но не к стеклу, а две ровные чистые стеклянные поверхности прилипнут друг к другу, но не к «велкро»; ровная и плоская поверхность – аналог неполярных связей С—Н и С—С, а крючки и петли «велкро» соответствуют отрицательно и положительно заряженным концам полярной молекулы.
Молекулы некоторых лекарств настолько неполярные и нерастворимые, что если дать их пациенту в виде таблетки, то даже ужасно кислой среды желудка будет недостаточно, чтобы выпустить их в кровоток, прежде чем они выведутся из организма; такая таблетка будет практически бесполезной.
Фармацевтические компании прилагают большие усилия, чтобы обойти эту проблему, поскольку они очень любят таблетки. Для этого существует классическая успешная стратегия: сделать неполярную молекулу полярной, добавив к ней заряд. В случае со стрихнином к нему нужно добавить по одной молекуле хлороводорода (HCl) на каждую молекулу потенциального яда. Эта стратегия работает, так как на «верхушке» молекулы, которую я изобразил на рисунке 30, торчит черный атом азота. Эта часть молекулы – основание (в противоположность кислоте), а именно амин, родственный простому реактиву аммиаку (NH3), с которым вы, возможно, знакомы по своему ящику с чистящими средствами. У него есть небольшой отрицательно заряженный конец, торчащий из неполярной основной части молекулы из-за того, что на нем расположена пара электронов, обращенных наружу от атома азота. Этой небольшой доли «полярности» недостаточно для того, чтобы сделать стрихнин растворимым в воде, но если добавить HCl, то Н+ немедленно прыгнет на это место, и внезапно у стрихнина окажется заряд +1 с ионом хлора для сохранения баланса, и теперь молекула готова к плаванию (при этом сохраняя свою химическую активность). Похожие реакции делают водорастворимыми такие лекарства, как кодеин, ципрофлоксацин и многие другие. В списке ингредиентов будет указан, например, «кодеина гидрохлорид», прямо как название соли – поскольку речь на самом деле о реакциях между кислотами и основаниями, в результате которых и вправду получаются соли, равно как в реакции HCl + NaOH, где получаются NaCl и H2O.
Из того, что мы узнали к этому моменту, мы могли бы предположить, что гидробромид стрихнина тоже окажется водорастворимым: здесь есть тот же самый Н+, а бромид-ион очень похож на хлорид-ион (к примеру, расположение ионов в твердом NaBr точно такое же, как в NaCl). Но нас ждет сюрприз: расположение ионов в кристалле гидробромида стрихнина сильно отличается от такового в гидрохлориде стрихнина. Анионам и катионам вода приятна примерно в одинаковой степени в обоих случаях, но у гидробромидной соли связи между молекулами
[178] гораздо крепче, чем у гидрохлорида, и поэтому она не слишком хорошо будет растворяться в воде. Не потому, что она не любит воду, а потому, что ей гораздо уютнее находиться на пляже с друзьями.
Так как же это помогло ловкому убийце? Он (или она) понял, что в спальне у миссис Инглторп стоят два флакона: один с гидрохлоридом стрихнина, а второй – с бромистым натрием. Добавьте бромистый натрий в раствор стрихнина, и протонированные молекулы стрихнина вскоре найдут своих бромидных приятелей и устроятся вместе с ними на пляже; вернее, они плотным слоем осядут на дне, а в воде будут плавать ионы натрия и хлорид-ионы. Небольшое количество тонизирующего средства со стрихнином выпивается каждый день, однако теперь оно практически лишено молекул стрихнина; уровень жидкости будет постепенно уменьшаться до того фатального момента, когда из флакона выпьют последнюю дозу, в которой теперь содержится весь стрихнин из изначального раствора; эта последняя доза окажется смертельной.



