Канцерогенез (или онкогенез) – это процесс зарождения и дальнейшего развития опухоли.
В современной онкологии выделяют несколько теорий канцерогенеза, но основной и получившей широкое распространение является мутационная теория. Для меня как гематолога этот вопрос представляет особый интерес, так как именно изучение патологических процессов, происходящих при опухолевых заболеваниях крови, привело к открытию одного из главных принципов онкогенеза.
В каждом живом организме ежедневно рождаются и умирают сотни миллиардов клеток. Каждая клетка содержит определенные «жизненные инструкции», по которым она развивается и функционирует. «Инструкции» записаны в хромосомах, состоящих из гигантских двухцепочечных макромолекул дезоксирибонуклеиновой кислоты (ДНК). ДНК состоит из генов – функциональных единиц, содержащих информацию о белках и некодирующих рибонуклеиновых кислотах (РНК), обеспечивающих жизнедеятельность клетки. У человека 98 % генетической информации содержится в хромосомах ядра клетки и 2 % – в хромосомах митохондрий. Все это вместе с рибосомами (компонентами клетки, синтезирующими белки на основе генетической информации) и клеточным центром (компонента клетки, играющая важную роль в клеточном делении) образует генетический аппарат клетки.
В ходе деления и развития клеток постоянно случаются мутации – и это естественный процесс. Нет ни одного стопроцентно верного способа этих мутаций избежать. Правильное питание, экологически чистая среда, отказ от курения и алкоголя – все это помогает организму бороться с возникающими мутациями, но не навсегда «отключить» их. Здоровый организм с нормально функционирующей иммунной системой справляется с возникающими мутациями.
Если на каком-нибудь этапе развития клеток крови происходит критическая мутация (нарушение генетического аппарата клетки), то они начинают «неправильно» развиваться, бесконтрольно делиться и не подвергаются апоптозу (запрограммированному самоубийству). Вот это самое бесконтрольное деление и накопление в организме патологических клеток называется злокачественной опухолью.
Приведу аналогию с ситуацией, знакомой вам, возможно, по документальным фильмам National Geographic: лососи имеют «генетическую программу» – вернуться из моря в реку, где родились. Помните кадры, как они поднимаются вверх по реке против течения, преодолевают пороги – и, добравшись до места своего рождения, дают жизнь потомству? Эта «программа» заставляет их бороться с течением, в результате чего они истощаются и умирают после того, как отложат и оплодотворят икру. Появляется новое поколение лососей, замещающее старое, и они повторяют все в точности так, как их родители.
Теперь представьте, что «программа» дала сбой. Лососи отказываются погибать после путешествия вверх по реке. Их популяция растет, и река становится похожа на московское метро в час пик. В итоге оскудевшая биота нерестовых рек не оставляет молоди никаких шансов на прокорм.
Дарвиновская теория естественного отбора говорит нам о том, что в природе есть регулирующие механизмы, которые «решают», кому остаться в живых, а кто должен выйти из игры. В нашем организме действуют точно такие же правила: мутирующие клетки благодаря иммунной системе погибают (подвергаются апоптозу), их место занимают новые. И если эта система ломается, мы говорим об онкологическом заболевании.
Непосредственной причиной формирования злокачественного клона (опухоли) является нарушение функционирования нормальных генов в результате различных хромосомных перестроек, мутаций отдельных генов или блокирования их регуляции.
Это открытие совершили в 1960 году два американских исследователя – Питер Ноуэлл (1928‒2016) и Дэвид Хангерфорд (1927‒1993). Изучая клетки костного мозга у пациентов с ХМЛ, они обнаружили укорочение одной из хромосом у всех обследованных больных
[44],
[45]. Несмотря на то что в это время еще не была разработана техника дифференциальной окраски хромосом, исследователи пришли к следующим заключениям: во-первых, подобная цитогенетическая аномалия строго специфична для ХМЛ, во-вторых, поскольку у всех (как выяснилось позже, все же не у всех, но у подавляющего большинства) пациентов с ХМЛ измененная хромосома обнаруживается во всех клетках крови, значит, болезнь происходит из одной клетки, которая получает преимущество в своем росте, что и ведет к распространению злокачественного клона. Эту «измененную» хромосому назвали филадельфийской – в честь города, в котором открытие было сделано
[46].
В том же году в историю генетики вошел и другой американский город – Денвер, где 17 участников научной конференции утвердили Международную систему цитогенетической номенклатуры хромосом человека (Денверскую классификацию), обеспечившую стандартизацию исследований хромосом. Обычная клетка организма человека содержит 46 хромосом. Две хромосомы из 46 являются половыми: их обозначили XX (у женщин) и XY (у мужчин), остальные 44 хромосомы (аутосомы), сгруппированные в 22 пары, были пронумерованы от 1 до 22, по мере убывания их длины.
Следующий важный этап в цитологии и понимании онкогенеза был связан с разработкой метода окраски хромосом. Американский генетик Джанет Роули (1925–2013), используя окрашивание хромосом, показала, что при ХМЛ происходит взаимный обмен генетическим материалом (транслокация) между хромосомами из 9-й и 22-й пар, в результате чего возникает филадельфийская хромосома
[47]. До этого считалось, что филадельфийская хромосома возникает в результате делеции (потери участка) 21-й хромосомы. Открытие стало настолько важным для терапии онкологических заболеваний, что в 2008 году было принято решение сделать 22 сентября (9/22) Международным днем поддержки пациентов с ХМЛ. К 1990 году в числе причин различных видов рака были выявлены более 70 транслокаций, в частности 90 % случаев лимфомы Беркитта связано с транслокацией, в которой участвуют 8-я и 14-я хромосомы.
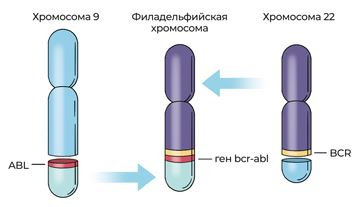
Рис. 23. Схема образования филадельфийской хромосомы
Из-за мутации в генах происходит нарушение «программы нормального функционирования» стволовых клеток. Измененные стволовые клетки начинают бесконтрольно делиться, их количество увеличивается, что приводит к образованию опухоли. Все дальнейшие исследования в этой области были сосредоточены на молекулярной расшифровке патологических процессов, что впоследствии привело к разработке направленной патогенетической терапии. Более подробно мы поговорим об этом далее.



