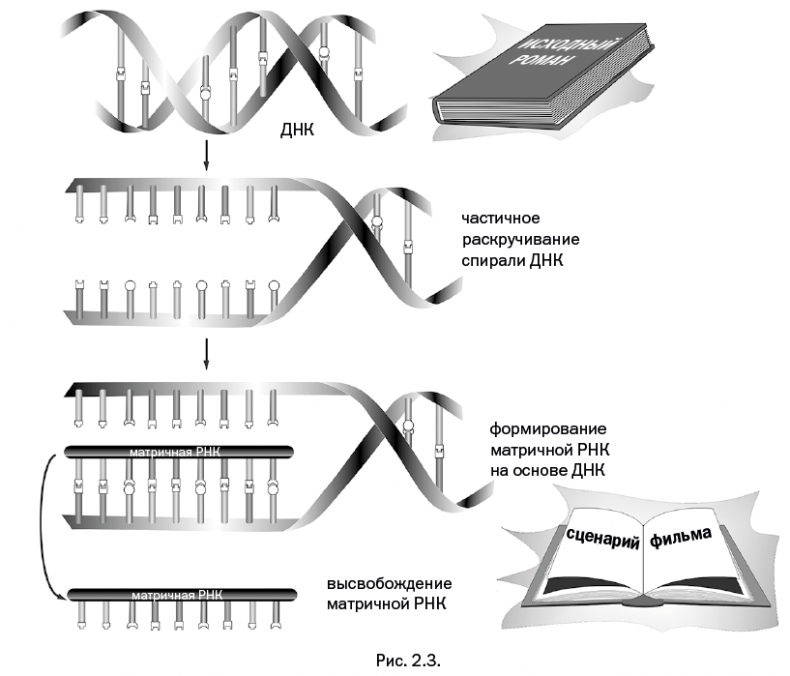
Выбранный для экранизации роман можно сравнить с широко известной молекулой ДНК (дезоксирибонуклеиновая кислота), в которой хранится вся исходная информация, то есть "инструкция" по сборке всех белков, нужных данному организму. Написание сценария – это, по существу, работа другой молекулы, так называемой матричной РНК (рибонуклеиновая кислота), которая "считывает" необходимую информацию с отдельных участков ДНК. Если точнее, матричная РНК собирается на основе ДНК, делая "слепок" с определенного ее участка (рис. 2.3). Происходит точное копирование последовательностей полярных групп по принципу "ключ – замок", что условно обозначено в виде впадин и выступов различной формы.
https://yadi.sk/i/vVWVvovpvQzuqw
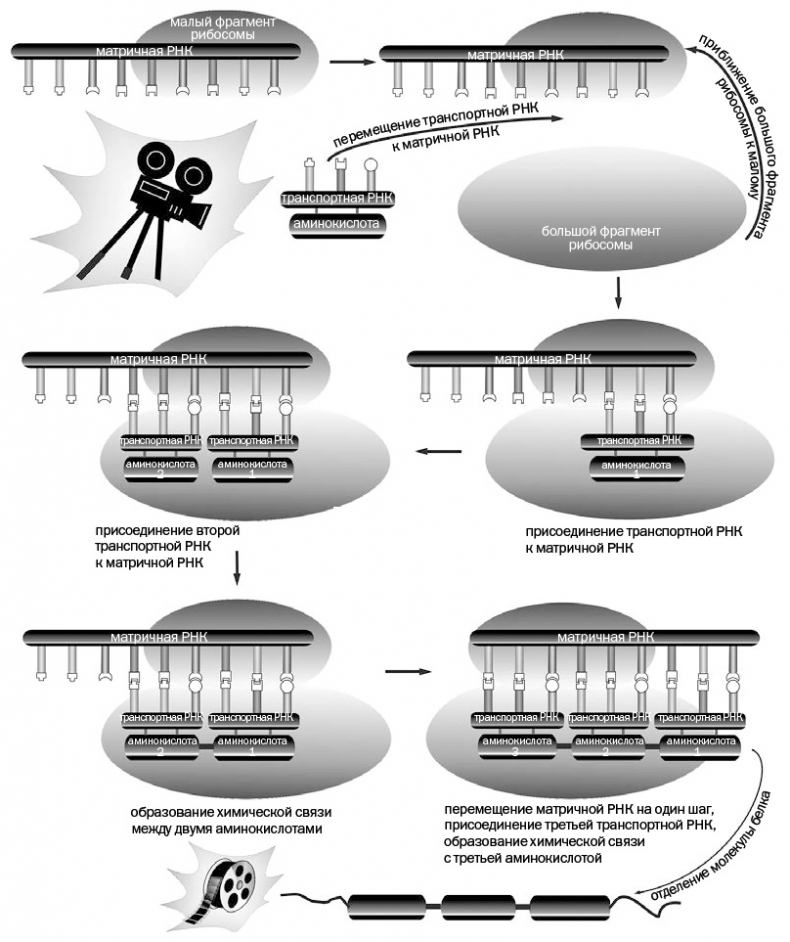
Прежде чем начинать работать, матричная РНК, содержащая скопированную информацию, направляется в малый фрагмент рибосомы и там закрепляется. Затем к процессу подключается другая РНК, называемая транспортной, и «привозит на себе» нужную аминокислоту. Молекула транспортной РНК, нагруженная определенной аминокислотой, располагается около определенного участка матричной РНК – причем в том месте, на которое РНК указывает с помощью тех же самых строго расположенных полярных групп, скопированных с ДНК. Эти группы подходят друг к другу, как ключ к замку (рис. 2.4). В тот же момент к малому фрагменту рибосомы присоединяется большой фрагмент – в итоге лабораторное помещение готово к работе. Все последующие процессы протекают на стыке двух фрагментов рибосомы. Назовем этот этап киносъемкой. К реагирующему центру приближается другая транспортная РНК со своей аминокислотой; две аминокислоты реагируют между собой, образуя фрагмент будущего белка. Образование связи между аминокислотами обозначено на рис. 2.4 в виде утолщенной горизонтальной черты. Можно сравнить этот процесс со съемкой определенного фрагмента из грядущего фильма. Затем рибосома продвигает матричную РНК, как транспортерную ленту, на один шаг, чтобы третья транспортная РНК с новой аминокислотой могла подойти к следующему участку. Прибывшая аминокислота реагирует с уже имеющимся фрагментом будущего белка, удлиняя его цепь на одно звено. В определенном месте на матричной РНК находятся специальные полярные группы, к которым не может «пристроиться» ни одна транспортная РНК. Эти группы указывают на то, что удлинение цепи необходимо завершать. После того как белковая цепь достигнет нужной длины, она отсоединяется от «монтажного устройства», рибосома возвращается в исходное состояние и вновь оказывается готовой к получению очередного белка. На выходе получается полимерная молекула белка – образно говоря, «кинолента». Рибосому, работающую как лентопротяжный механизм, можно назвать кинематографическим термином «монтажная». Одна и та же рибосома может синтезировать самые разные белки, необходимы лишь соответствующая матрица, то есть матричная РНК, и строительный материал – аминокислоты, подвозимые специальным транспортом – транспортными РНК. Работает рибосома очень быстро, собирая за одну секунду участок цепи из 10–15 аминокислот, причем исключительно аккуратно, не допуская ошибок при сборке молекулы из сотен звеньев. Полный синтез белковой молекулы проходит приблизительно в течение одной-полутора минут. В процессе жизнедеятельности организма белки постоянно расходуются и потому регулярно воспроизводятся рибосомой по описанной схеме.
Победить – значит сломать
Выяснение принципа работы рибосом ознаменовало важный этап в развитии науки, поскольку синтез белка – это основной процесс жизнедеятельности. Однако значимость работы, отмеченной Нобелевской премией, этим не исчерпывается. Результаты исследования имеют конкретное прикладное значение при борьбе с болезнетворными бактериями. Авторам удалось создать трехмерные модели, которые показывают, как различные антибиотики взаимодействуют с рибосомами некоторых бактерий. Выяснилось, что лекарственные препараты – антибиотики – блокируют некоторые рабочие узлы в рибосомах бактерий. Очень важным оказалось следующее обстоятельство: рибосомы высших организмов – например, человека – намного сложнее, чем те, что у бактерий. Благодаря этому лекарство может повреждать рибосомы болезнетворной бактерии, не причиняя вреда рибосомам человека. Большая группа антибиотиков действует именно на бактерий – например, тетрациклин препятствует взаимодействию транспортной РНК с рибосомой, а эритромицин блокирует взаимодействие двух оказавшихся рядом аминокислот. Если какой-то узел в машине по производству белка сломан, то гибнет и сам организм, то есть бактерия.
К сожалению, до сих пор использование антибиотиков не обеспечивало стопроцентного успеха, поскольку бактерии постоянно видоизменяются, образуя новые формы – штаммы, устойчивые к антибиотикам. Теперь, когда принципы работы рибосом понятны, поиск новых антибиотиков и изучение механизма их действия поднимают современную фармакологию на новый уровень. Есть все основания полагать, что открытия нобелевских лауреатов помогут найти неизвестные ранее эффективные антибиотики.
Вполне заслуженно, но не совсем справедливо
Результаты научной работы по расшифровке структуры рибосомы и исследованию механизма ее работы, безусловно, заслуживают Нобелевской премии – и большинство ученых с этим согласны. Тем не менее многие считают спорным выбор Нобелевским комитетом именно этих трех лауреатов. Такое всегда происходит при обсуждении результатов работы комитета. Прежде всего Нобелевская премия за один конкретный год не может быть присуждена более чем трем ученым – таково положение о премиях. В результате почти всегда остаются обойденными те, чей вклад в открытие, отмеченное премией, тоже заслуживает признания. Подобное произошло и в этот раз. Точную молекулярную структуру рибосомы и описание принципов ее работы почти одновременно с обладателями премии опубликовал Гарри Ноллер из Калифорнийского университета в Санта-Крус, США. Эта работа была выполнена при участии Марата и Гульнары Юсуповых, ранее работавших в Институте белка в г. Пущино и впоследствии продолживших исследования в лаборатории Ноллера. Результаты работы Нобелевского комитета никогда не пересматриваются и не отменяются, и в результате возникает ощущение некоторой несправедливости. К чести некоторых нобелевских лауреатов, следует сказать, что известны случаи, когда премированный лауреат отдавал часть своей премии незаслуженно обойденному ученому.
Коротко о лауреатах
Во-первых, отметим, что все три лауреата не сотрудничали, у них не было совместных публикаций – тем не менее они внимательно следили за работами друг друга. Можно сказать, что их работа напоминала дружескую конкуренцию.
Ада Йонат стала четвертой женщиной – лауреатом Нобелевской премии по химии. Она родилась 22 июня 1939 г. в Иерусалиме, в бедной семье евреев-иммигрантов, выходцев из польского города Лодзь. Ее отец был раввином – он умер, когда Аде было 11 лет, а ее младшей сестре Нурит – 2 года. Мать, всю жизнь остававшаяся домохозяйкой, делала все возможное, чтобы помочь дочерям получить образование. Обе сестры отлично учились в школе, но девочкам приходилось подрабатывать частными уроками и мытьем полов у соседей. Научную карьеру выбрала только Ада. После прохождения обязательной армейской службы она поступила в Еврейский университет в Иерусалиме. Училась с охотой, по выходным и в каникулы подрабатывала прядильщицей на ткацкой фабрике, чертежницей в автобусном кооперативе, помощницей повара в рабочей столовой. По окончании университета в 1962 г. она получила степень бакалавра по химии, а два года спустя – степень магистра по биохимии, после чего начала научно-исследовательскую работу в Институте им. Вейцмана в г. Реховоте, Израиль. В 1969 г. Ада защитила диссертацию по специальности «Рентгеновская кристаллография», после чего два года проработала в США. По возвращении на родину в 1970 г. Йонат продолжила научную деятельность в Институте им. Вейцмана. С 1986 по 2004 г. она возглавляла научные исследования в области молекулярной биологии в Институте общества Макса Планка в Гамбурге. В настоящее время работает в Институте им. Вейцмана, в котором, по мнению авторитетного американского научного журнала The Scientist, созданы лучшие условия для работы ученых.




