В каждой клетке находится большое количество протеасом, и все они предназначены природой для расщепления белка. Долгое время ученые полагали, что белковой молекуле довольно просто попасть в этот «утилизирующий контейнер», но если бы все было так, то любой, в том числе и нужный белок, попавший во «чрево» протеасомы, уничтожался бы. Было неясно, почему туда попадет не любой, а строго определенный белок – именно тот, который следует утилизировать. Очевидно, какое-то «устройство» проводит сортировку, отбирая только то, что подлежит ликвидации.
Новая роль старого знакомого
Ранее было сказано, что процессы расщепления белков в пищеварительном тракте (вместе с остальными продуктами) протекают с выделением энергии. Начав изучать процессы разрушения внутриклеточных белков, А. Чехановер, А. Гершко и И. Роуз обратили внимание на одно необычное обстоятельство: расщепление белков в клетке протекает не с выделением, а с поглощением энергии. На это указывал следующий обнаруженный факт: расщепление клеточных белков происходило только в присутствии аденозинтрифосфата (сокращенно АТФ – вещество, представляющее собой универсальный источник энергии для всех биохимических процессов), а в отсутствии АТФ расщепления не случалось. Результаты столь простых по замыслу и по исполнению экспериментов вначале не заинтересовали никого из коллег-биохимиков, но именно эти опыты привели к последующим масштабным исследованиям. Обратив внимание на такое явление, ученые провели более детальное его изучение и установили, что разрушение протекает в присутствии еще одного белка, притом обладающего высокой активностью. Оказалось, что белок известен давно – он был открыт в 1970-х гг. американским биохимиком Г. Голдстейном и получил название убиквитин (лат. ubique – «вездесущий»), поскольку его находили во многих тканях и органах.
К началу описываемой работы убиквитин был хорошо изучен: он представляет собой белок, собранный из 76 аминокислотных остатков, а его молекулярная масса сравнительно невелика – немногим более 8000. Он весьма стабилен, и участие в различных биохимических процессах не приводит к изменению его структуры. На рис. 2.6 его строение показано в виде трехмерной модели, а также приведена упрощенная структура. Молекула содержит одно спиральное образование (альфа-спираль) и четыре плоские ленты (бета-структуры). Поясним, что это две наиболее распространенные формы белков – спираль и плоская лента.
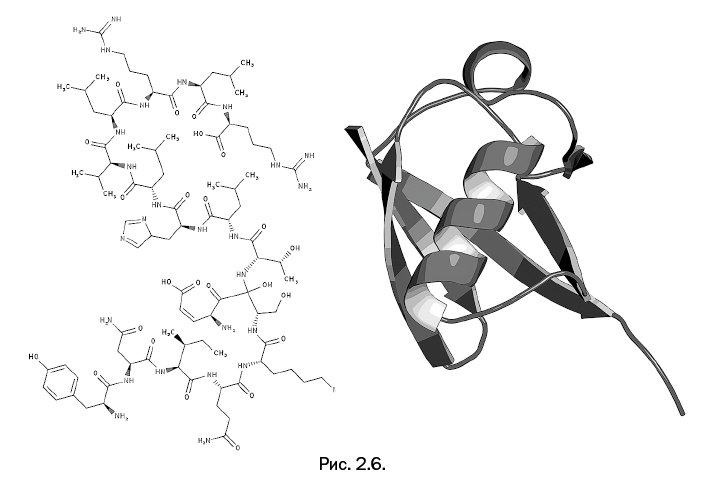
Несмотря на то что убиквитин находили во многих клетках живых организмов и строение его было установлено, его роль в биохимических процессах была не ясна.
Авторы работы высказали мысль, что решающая стадия в процессе утилизации белков – это присоединение убиквитина к тому белку, который необходимо уничтожить. Последующие исследования это подтвердили, было установлено также, что вход в протеасому (фабрику уничтожения) обычно закрыт. Попасть в нее может только тот белок, который отмечен специальной меткой, и тогда вход в протеасому открывается. Роль "черной" метки играет убиквитин. Процесс прикрепления убиквитина к молекуле белка, подлежащего уничтожению, авторы назвали "поцелуем смерти", изобразив в виде ярлычка с черепом. Столь мрачное название невольно хочется смягчить, добавив к нему три слова: "поцелуй смерти во имя жизни", поскольку очистка от мусора – залог дальнейшего развития.
Входя в протеасому, полимерная цепь уничтожаемого белка разворачивается и "протягивается" через центральный канал цилиндра, при этом она распадается на мелкие звенья (иногда вплоть до отдельных аминокислот), которые выводятся из противоположного отверстия протеасомы (рис. 2.7. Перейдя по ссылке: https://yadi.sk/i/iqnvFDINvG-4_Q, читатель сможет посмотреть ролик, в котором показан этот процесс.). Сам убиквитин внутрь протеасомы не заходит, а после уничтожения отмеченной молекулы освобождается и «помечает» другую молекулу.
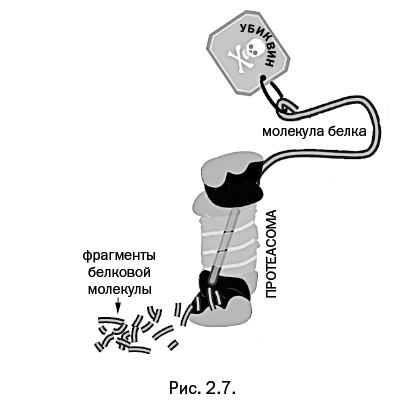
Этот необычный процесс выглядит еще зрелищнее, если мы примем во внимание, что в некоторых случаях к уничтожаемому белку присоединяется не одиночная молекула убиквитина, а сразу несколько молекул, которые связаны между собой в необычную цепочку.
Перед тем как присоединиться к белку, который следует разрушить, убиквитин активируется с помощью специального фермента (биологического катализатора) – именно на этой стадии требуется затрата дополнительной энергии, которую поставляет упомянутый ранее АТФ. Так было найдено объяснение факту, с которого, собственно говоря, и началось изучение всего этого механизма.
Результаты проведенных исследований позволили понять некоторые неразгаданные ранее особенности развития живых организмов. Например, растения в цветке содержат как отцовские клетки (пыльцу), так и материнские (расположенные в пестике цветка). Поскольку они находятся рядом, то, казалось бы, самоопыление неизбежно, что должно приводить к генетическому вырождению и вымиранию вида. Оказалось, что убиквитин помечает белки собственной пыльцы, что приводит к их уничтожению, а пыльца, попавшая в цветок в результате перекрестного опыления, убиквитином не затрагивается.
В процессе деления клетки ее ДНК удваиваются, и все это время специальный белок, словно шнур, удерживает рядом друг с другом удваивающуюся пару. После того как произошло удвоение, молекулы ДНК должны разойтись, следовательно, белок, удерживающий их вместе, должен быть уничтожен, иначе процесс дальнейшего развития остановится. В этот момент в дело вступает убиквитин, ответственный за удаление ненужных белков.
Схема некоторых биохимических процессов напоминает работу устройств с взаимотормозящими противовесами. В иммунных клетках организма присутствует белок, который включает действие иммунной системы, уничтожающей проникший в клетку вирус. В нормальном состоянии действие этого белка заторможено другим белком – ингибитором (замедлителем). Если в клетку попадает вирус, то включается убиквитин, который начинает метить белок-ингибитор. Уничтожение ингибитора ведет к тому, что вступает в действие заторможенный ранее белок, запускающий иммунную систему, и в результате вирус уничтожается.
Изученный убиквитиновый механизм открывает новые перспективы в борьбе с различными заболеваниями. Образование злокачественных опухолей или ослабление иммунной системы клетки так или иначе связаны с нарушением убиквитиновой защиты клетки от нежелательных белков. Процессы ненормального или неправильного расщепления белков приводят ко многим заболеваниям (например, болезнь Паркинсона, болезнь Альцгеймера), некоторым онкологическим заболеваниям и запускают процессы старения организма. Изученный механизм убиквитиновой защиты открывает возможность поиска различных воздействий на процесс – чтобы запускать его в нужную сторону. Очевидно, затормозить действие убиквитина можно, например снизив содержание АТФ, дающего необходимую для его работы энергию. По существу, это использование эффекта, с открытия которого и началась вся работа. Возможны и другие способы воздействия на процесс. В настоящее время ведутся интенсивные разработки различных лекарственных препаратов, основанные на понимании механизма убиквитиновой защиты. В 2004 г. в США было начато производство первого такого препарата – антиракового средства Velcade. Другое реализованное применение – создание надежного теста на бесплодие у мужчин, использующего анализ присутствия убиквитина.




