Ранее было сказано, что магнитные свойства материалов зависят от присутствия в них доменов – крупных агрегатов магнитоактивных атомов или молекул. В 1990-х гг. произошло событие, заметно расширившее представления о возможностях магнитных материалов. Оказалось, что можно намагничивать отдельные молекулы в веществе при отсутствии доменной структуры. Появился новый класс магнетиков – мономолекулярные магниты (single-molecule magnets), которые способны сохранять намагниченность после удаления внешнего магнитного поля, то есть обладают магнитной «памятью». На данный момент такое явление наблюдают только при пониженных температурах, зачастую близких к абсолютному нулю. Как и у обычных магнитов, у мономолекулярных существует петля гистерезиса. На сегодня получено крупное семейство соединений, обладающих свойствами мономолекулярных магнитов, наиболее часто это различные комплексы лантаноидов. Величина коэрцитивной силы у некоторых из них достигает 50 эрстед. Молекулы-магниты в настоящее время интенсивно изучают: в перспективе они могут широко использоваться в качестве элементов высокоплотной магнитной памяти.
Экспериментально было установлено, что некоторые из каркасных металлорганосилоксанов способны намагничиваться и сохранять это состояние после удаления внешнего магнитного поля, что подтверждено полученными петлями гистерезиса (рис. 6.26). Наибольшую коэрцитивную силу – 350 Э (при температуре 1,8 К) – показало соединение, содержащее в каркасе пять атомов никеля.
Заманчивой выглядит идея сделать элементом магнитной памяти отдельную молекулу. Такие соединения открывают перспективы для создания вычислительных устройств следующего поколения – квантовых компьютеров.
Еще один «родственник» углерода
Речь пойдет о следующем элементе группы углерода после кремния – это германий. Сходства с углеродом у него практически нет, и правильнее было бы его назвать соперником кремния. Открытие германия было предсказано Д. И. Менделеевым (экасилиций) в 1871 г., а получен он был в 1886 г. К. Винклером, после чего между двумя учеными возникли дружеские отношения.
Наступил этап последовательного изучения германия, и были найдены его полезные свойства. Элементарный германий "развивался" по своим законам, открыв эпоху полупроводниковой электроники и продемонстрировав необычные оптические свойства (оптика для приборов ночного видения). В то же время изучение химических соединений этого элемента во многих случаях воспроизводило химию соединений кремния – ближайшего соседа и аналога по периодической системе, который был изучен более масштабно.
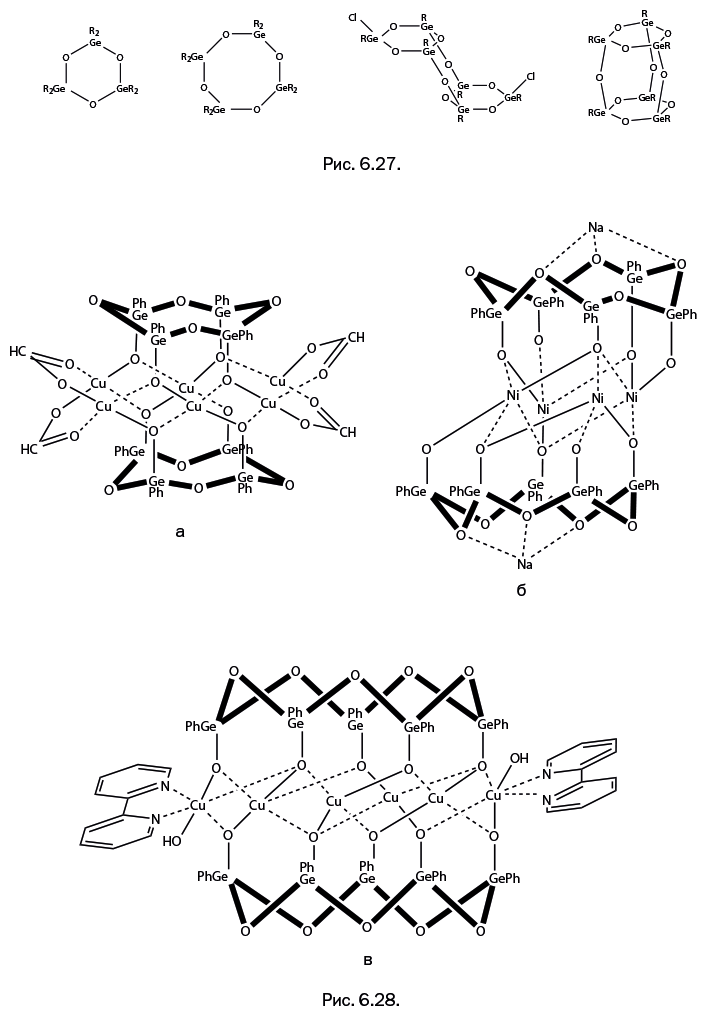
Германий стал более "управляемым", когда к нему применили опыт, накопленный при работе с кремнийорганическими соединениями. В химии германия появилась отдельная глава, когда исследователи перешли к соединениям, содержащим органическую группу у атома германия – то есть группировку С-Ge, а также поместили между атомами германия атомы кислорода. Соединения с фрагментами -RGe-O-GeR– называют органогермоксанами, по аналогии с органосилоксанами. Были получены различные германийсодержащие циклические соединения, напоминающие органосилоксановые структуры (рис. 6.27).
Вполне естественно было ожидать появления металлсодержащих гермоксанов (M-O-Ge), то есть класса соединений, родственного металлорганосилоксанам (M-O-Si). Сравнительно недавно он действительно (в 2016 г.) был создан в результате работы отечественного химика-элементоорганика А. Н. Биляченко (Институт элементоорганических соединений РАН и Российский университет дружбы народов), который уже имел большой опыт обращения с металлосилоксанами. Это подтверждает и показанная выше диаграмма (рис. 6.24): все структуры, кроме одной, получены А. Н. Биляченко.
Методики синтеза металлсодержащих гермоксанов близки к тем, что были использованы при получении металлорганосилоксанов. Некоторые из полученных каркасов имеют форму, подобную кремнийсодержащим соединениям. Это призматические структуры, имеющие в основаниях призмы органогермоксановые циклы различного размера – например, тетрагермоксановые, удерживающие шесть ионов Cu (рис. 6.28а), пентагермоксановые с четырьмя ионами Ni (рис. 6.28б) или с шестью ионами Cu в структуре (рис. 6.28в). Для наглядности гермоксановые циклы показаны утолщенными. В соединении с четырьмя ионами никеля (рис. 6.28б) при температуре 1,8 К зафиксирована петля гистерезиса с весьма значительной величиной коэрцитивной силы 580 Э (сравни с рис. 6.26).
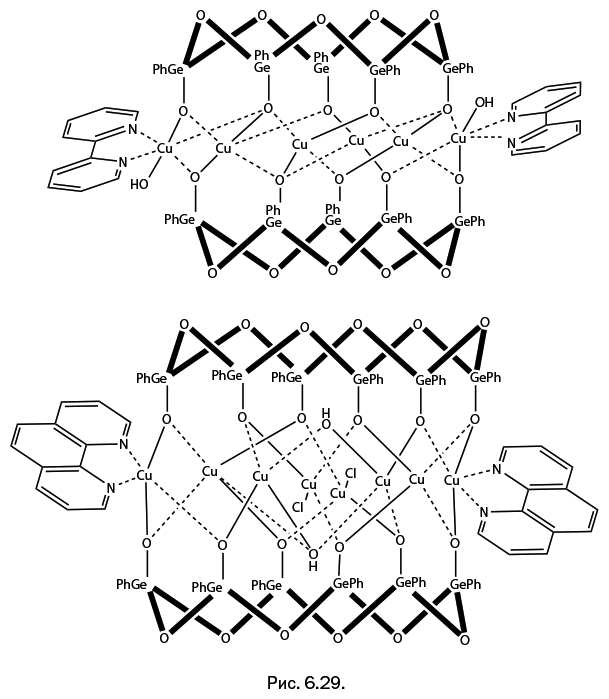
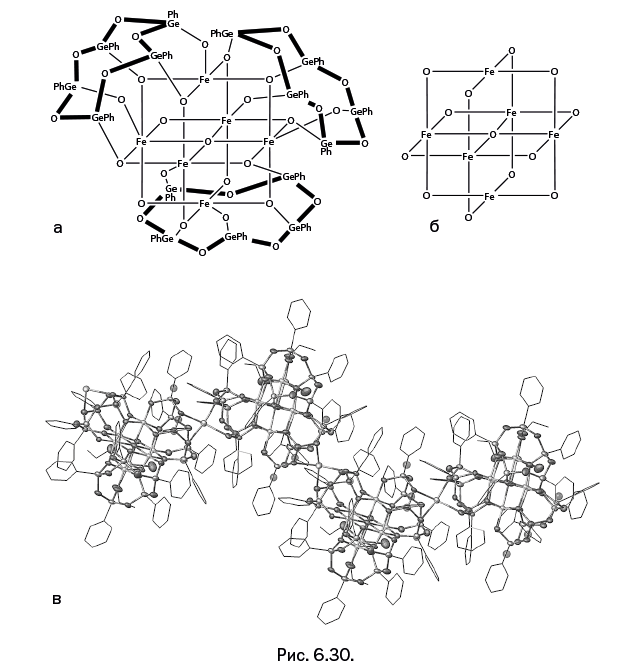
Гексагермоксановые циклы могут удерживать одновременно шесть (рис. 6.29, вверху) или восемь ионов Cu (рис. 6.29, внизу).
При изменении методики синтеза были получены соединения, архитектура которых оказалась весьма экзотической и не имеющей аналогий с металлосилоксанами. Три пентагермоксановых цикла, расположенных в форме трехлепесткового цветка, одновременно удерживают шесть ионов Fe и два иона Na (рис. 6.30а). Ионы Fe, находящиеся внутри каркаса, расположены в трех взаимоперпендикулярных плоскостях (рис. 6.30б). У ионов натрия особая роль: они координационно связываются с двумя гермоксановыми циклами, расположенными в соседних молекулах. В результате образуется зигзагообразная цепочка (рис. 6.30в).
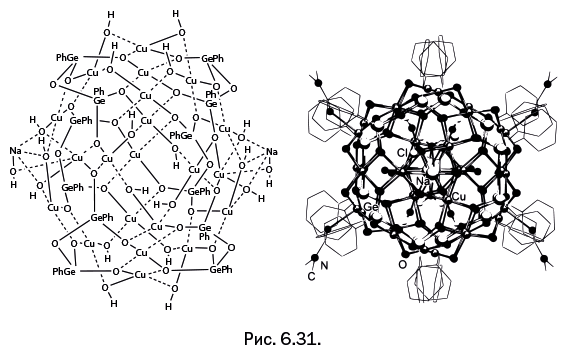
Получена медьсодержащая гермоксановая структура, содержащая 21 ион Cu – это рекордное количество. Из-за своей формы молекула получила в научной литературе название «артишок» (рис. 6.31).
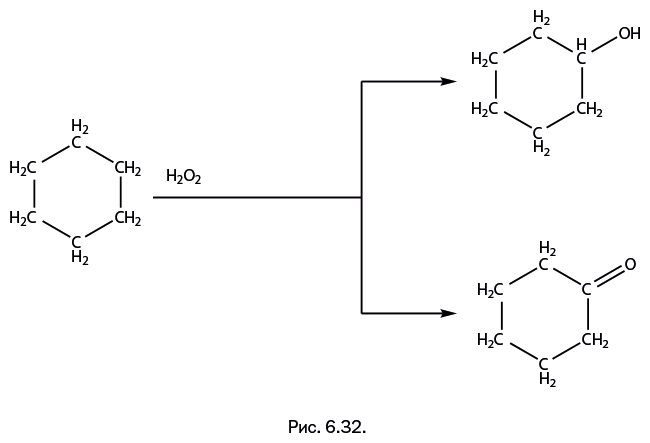
Это соединение оказалось эффективным катализатором окисления циклогексана до циклогексанола и циклогесанона по схеме, показанной на рис. 6.32.
В одной структуре могут сочетаться ионы металлов различной природы – например, Fe и Cu (рис. 6.33а). Каркас собран из двух фрагментов – крупного агрегата из пяти ионов Fe в окружении двенадцатизвенного гермоксанового цикла (для наглядности он показан плоским на рис. 6.33б) и небольшой крышки, содержащей два иона Cu (рис. 6.33в). Соединение эффективно катализирует окисление углеводородов, что было изучено на модельной реакции, показанной на рис. 6.32.

