История гласит, что Бест сорвал самый крупный выигрыш в орлянку за всю историю медицины. Первоначально на участие в проекте могли претендовать два студента. Бест и его приятель Кларк Нобл бросили монету, чтобы решить, кто пойдет работать к Бантингу, и Бест выиграл. Вначале они договорились сменить друг друга в середине лета, но к тому времени Бест глубоко погрузился в работу (и хорошо овладел техническими навыками), так что по обоюдному согласию он остался. Так бросок монеты решил, кому достанется доля научной славы.
Идея Бантинга оказалась верной. Начало исследований на собаках было столь многообещающим, что к январю 1922 г. стало возможным приступить к испытаниям на людях. И тогда на сцену выходит новый персонаж — Джеймс Бертрам Коллип, решивший вопрос, как очистить вытяжку поджелудочной железы и получить безопасный препарат для инъекций людям. К нему обратились после того, как у первого пациента, получившего недостаточно очищенную вытяжку из собачьей поджелудочной железы, развилась тяжелая аллергическая реакция. Истории тех времен повествуют о необычайно эффектных выздоровлениях. В частности, говорят, что, как только был выделен чистый препарат, коллеги Бантинга обошли палату, полную умирающих детей в коме, и сделали каждому укол. И к тому моменту, когда они дошли до последнего ребенка, первый уже очнулся от комы.
Конечно, о том, правдива ли эта история, невозможно судить по первому научному отчету об инсулинотерапии
, опубликованному в Canadian Medical Association Journal. Эта статья невероятно, бесконечно скучна. И только на середине второй страницы (притом что объем статьи всего-то чуть более пяти страниц) вообще упоминается о лечении людей. Выводы осторожные и взвешенные, общий их смысл: «мы можем отметить, что в крови пациентов произошли некоторые изменения и их самочувствие, по всей видимости, улучшилось».
Пусть Бантинг со товарищи и не спешили трубить в фанфары, сообщение о подобном открытии не могло остаться незамеченным, и новость вскоре облетела весь мир. На следующий год Бантинг и Маклеод получили Нобелевскую премию по физиологии и медицине. Бантинг поделился премиальными деньгами с Бестом, а Маклеод — с Коллипом. Можно вообразить себе чувства людей, членам семей которых только что диагностировали диабет (в то время, когда эта информация уже появилась), но промышленное производство инсулина еще не наладили. Наверняка многие умерли, хотя метод лечения был уже известен, а кого-то удалось спасти в последний момент.
Как бы то ни было, 30 лет спустя, к тому времени когда Фреду Сэнгеру понадобился очищенный белок инсулин для исследований, ему достаточно было пройтись до ближайшей аптеки и купить ампулу. Подход Сэнгера состоял в том, чтобы упростить проблему — не пытаться расшифровать последовательность всей молекулы белка, а разбить ее на более мелкие кусочки, с которыми проще работать. Он разработал химические методы определения последовательности аминокислот в этих коротких отрезках, а затем совместил перекрывающиеся отрезки, чтобы определить всю белковую последовательность. Эта идея имела долгосрочные научные перспективы. Как мы увидим, почти полвека спустя Celera — компания Крейга Вентера — применит фактически тот же подход при секвенировании человеческого генома, и эта технология до сих пор сохраняет свое значение в генетике. В 2018 г. с ее помощью был прочитан геном коалы.
Сэнгер не просто выявил последовательность аминокислот инсулина. При всей важности этого достижения оно было незначительным на фоне открытия того факта, что у белков есть фиксированная последовательность, от которой зависят их структура и функции. Многие последующие открытия, в том числе понимание того, как ДНК кодирует белки, стали возможны только благодаря базовому знанию, что белок на самом деле не что иное, как цепочка из аминокислот.
Следующим оригинальным решением Сэнгера (которое принесло ему вторую Нобелевскую премию) стало изобретение способа прочитать последовательность нуклеотидов ДНК. Его метод, изложенный в публикации 1977 г., до сих пор называется методом Сэнгера (или методом секвенирования по Сэнгеру). Он стал краеугольным камнем проекта «Геном человека». Вначале секвенирование по Сэнгеру требовало изрядной возни с радиоактивными изотопами, но позже придумали метить азотистые основания ДНК разноцветными флюоресцентными маркерами — это безопаснее, а кроме того, позволяет увеличить масштабы исследований. И они действительно были увеличены.
Мы до сих пор применяем метод Сэнгера в диагностических лабораториях. Вот пример результатов такого анализа:
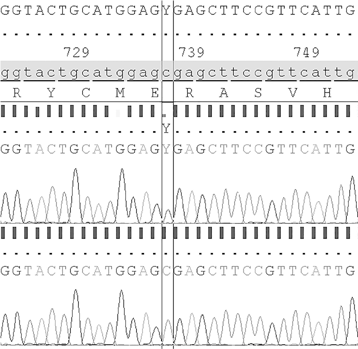
На этой иллюстрации верхний отрезок принадлежит носителю генетической мутации, а нижний — человеку, у которого ее нет. Здесь картинка черно-белая, но в общепринятой практике А обозначается зеленым, Ц (С) — синим, Г (G) — черным, а Т — красным. Каждый из разноцветных пиков соответствует азотистому основанию ДНК, поэтому по цветам пиков можно прочесть последовательность: Г, Г, Т, А, Ц, Т и так далее. Можно, конечно, просто прочитать последовательность букв, ради удобства стоящих над пиками, но так понятнее сам принцип.
Посредине этого отрезка ДНК, между двумя вертикальными линиями, в нормальной последовательности должен стоять пик Ц (С); на том же месте в верхнем отрезке, если бы рисунок был цветным, вы бы разглядели красный пик Т — но при ближайшем рассмотрении оказалось бы, что нормальный синий пик Ц тоже присутствует. Это означает, что в одной из двух копий гена — обычная последовательность, а в другой — ее вариант (мутация). Обе копии, измененная и неизмененная, попали в образец и подверглись реакции секвенирования. Основания, оставшиеся неизменными, одинаковы для обеих последовательностей и на графике не различаются. Но в том месте, где произошла мутация, у половины ДНК в пробирке Ц, а у половины Т, и эти места у двух последовательностей совпадают. Вот почему пик в этом месте примерно в два раза меньше, чем пик Ц на нормальной последовательности.
Теперь это проделать нетрудно, поскольку мы уже знаем последовательность интересующего нас гена. Но метод Сэнгера также можно использовать для расшифровки неизвестных ранее последовательностей ДНК. Начинаете с известного отрезка и продвигаетесь дальше, вступая на новую территорию, пока не встретитесь с тем, кто движется в противоположном направлении. Именно такой подход и использовался в проекте «Геном человека».
Итак, к концу 1980-х гг. мы располагали инструментами, чтобы завершить работу. Тем не менее завершение представлялось делом далекого будущего. В 1987 г. Министерство энергетики США — организация, которая, как известно, никогда не боялась рисковать, — запустила первый подобный проект. Их целью было найти способ уберечь геном от вредного воздействия радиации — потенциально важная задача в ту пору, когда атомные электростанции были значимым и постоянно растущим сегментом энергетики страны. В 1988 г. Национальный институт здравоохранения и Министерство энергетики объединили усилия и получили финансирование от Конгресса США, чтобы попытаться решить эту задачу.



