Чрезвычайно велика и значима роль спонтанных сообщений, добровольное участие врачей и пациентов в информировании служб по мониторингу безопасности ЛС о НР, взвешенная и объективная оценка. Однако опасения могут быть завышенными. Так, например, зная о связи между приемом БФ и патологией верхних отделов ЖКТ, несомненно, все события и симптомы неблагополучия со стороны органов желудочно-кишечного тракта, скорее всего, будут истолкованы как НР.
Следует помнить, что НР, возникшая на фоне приема БФ, еще не означает «из-за» или «вследствие».
Необходимо, как уже говорилось выше, накопление, подтверждение и объяснение данных.
Раннее предупреждение о возможной связи подозреваемого препарата и изучаемой НР необходимо для информирования и повышения уровня образования врачей, защиты больного, принятия соответствующих мер.
На сегодняшний день прямая связь между редкими НР и приемом БФ остается спорной, не доказанной (см. табл. 12). Представляется необоснованным заявление (предложение) о сокращении назначений БФ. БФ – высокоэффективные препараты для лечения ОП.
Доказательства эффективности получены и подтверждены многочисленными исследованиями, многолетней реальной практикой.
Таблица 12
Характеристика типов неблагоприятных реакций
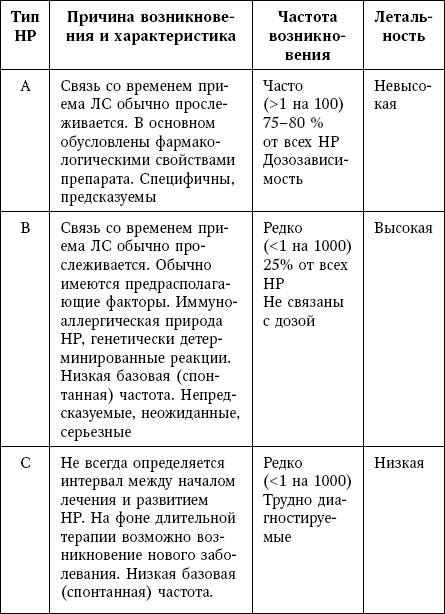
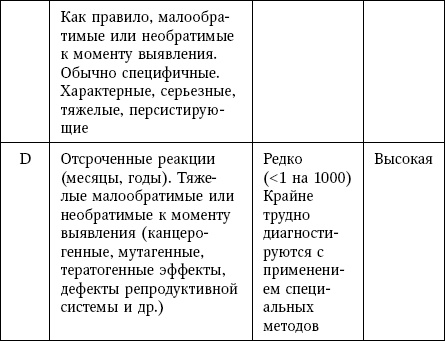
Таблица 13
Заболеваемость раком пищевода
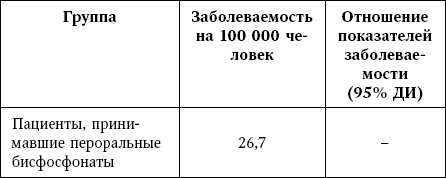
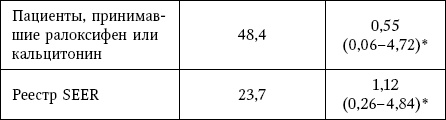
* Широкие доверительные интервалы обусловлены низкой частотой заболевания.
Препараты заместительной гормональной терапии и их производные
Клиническая фармакология
Назначение заместительной гормонотерапии (ЗГТ) женщинам в постменопаузе уменьшает костную резорбцию и потерю костной массы – по результатам разных исследований прирост костной массы за 12 мес. терапии в поясничных позвонках составляет 6–12 % (уровень доказательности А). Эпидемиологические данные подтверждают, что использование эстрогенов снижает риск переломов позвоночника, шейки бедра и предплечья (уровень доказательности А). Применение ЗГТ предотвращает потери костной массы как у здоровых женщин, сохраняя МПК, так и при остеопении, повышая плотность костной ткани. Эффект ЗГТ коррелирует с длительностью терапии и дозами эстрогенов (уровень доказательности А). Эффективность ЗГТ повышается при комбинации с препаратами кальция и витамина D3 (уровень доказательности А).
Форма применения эстрогенов и тип прогестагена принципиального значения для костного обмена не имеют (уровень доказательности В).
Длительные проспективные исследования подтвердили (в том числе WHI), что использование эстрогенов снижает риск переломов бедра и позвоночника (клинических) на 34 %, других остеопоротических переломов, на 24 %.
Побочные эффекты ЗГТ включают прибавку веса и повышение артериального давления. Прогестин может вызывать раздражительность и перепады настроения; в этом случае следует уменьшить его дозу. ЗГТ увеличивает риск тромбоза глубоких вен и холелитиаза. У пожилых возрастает риск развития рака молочной железы. Так, плацебоконтролируемое исследование WHI (Women’s Health Initiative) 16 600 постменопаузальных женщин в возрасте 50–79 лет, получавших ежедневно эстрогены либо эстроген-гестагенную терапию более 5 лет (дизайн исследования предусматривал продолжительность 8,5 года, но оно было преждевременно остановлено), показало отрицательное влияние длительно проводимого лечения на различные системы организма: на 29 % увеличивался риск коронарной болезни сердца, на 41 % – риск инсульта, на 26 % – риск рака молочной железы, особенно между 4-м и 5-м годами профилактики; остается высоким риск тромбоэмболии, не выявлено положительное влияние на болезнь Альцгеймера, при этом показано снижение случаев рака прямой кишки на 37 %.
В 1990–1999 гг. большинство медицинских ассоциаций безоговорочно рекомендовало проведение ЗГТ в качестве первой линии препаратов для профилактики потерь МПК в трабекулярной и кортикальной ткани у женщин в менопаузе. Однако в связи с указанными побочными эффектами многие медицинские ассоциации в 2002–2004 гг. опубликовали рекомендации, ограничивающие длительное применение ЗГТ для купирования климактерических симптомов, в том числе и потери МПК.
План обследования пациенток перед назначением эстроген-гестагенной терапии и противопоказания к терапии сохраняются прежними.
Селективные модуляторы эстрогенных рецепторов (СМЭР)
Химические соединения негормональной природы, которые прочно связываются с рецепторами эстрогенов, подобно эстрадиолу. В одних тканях (костная ткань) они проявляют себя как агонисты эстрогенов, а в других (эпителий молочных желез) – как антагонисты женских половых гормонов.
К настоящему времени из значительного количества соединений, определяемых как СМЭР, пока только ралоксифен одобрен для профилактики и лечения остеопороза.
Ралоксифен
Фармакологическое действие
Селективный модулятор эстрогеновых рецепторов. Оказывает избирательное стимулирующее действие на нерепродуктивные ткани и подавляющее – на репродуктивные ткани. Биологическое действие, как и действие эстрогенов, опосредовано высокоаффинным связыванием с эстрогенными рецепторами и регуляцией экспрессии генов. Это связывание приводит к дифференциальной экспрессии многочисленных генов, регулируемых эстрогенами, в различных тканях. В сочетании с препаратами Ca2+ увеличивает плотность костной ткани бедренной кости и позвоночника. Вызывает снижение резорбции костей и задержку Ca2+, в основном за счет уменьшения его потерь через мочевыделительную систему. Уменьшает общий холестерин, холестерин ЛПВП, фибриноген сыворотки, увеличивает субфракцию ЛПВП-С2.
Фармакокинетика
Абсорбция – 60 %. Абсолютная биодоступность – 2 %. Интенсивно метаболизируется в печени с образованием глюкуронидных конъюгатов. T1/2 – 24–30 ч. Подвергается кишечно-печеночной рециркуляции. Выводятся ралоксифен и его метаболиты в течение 5 дней, главным образом через кишечник, почками – 6 %. У больных с печеночной недостаточностью концентрация ралоксифена в плазме в 2,5 раза выше, чем у здоровых (коррелирует с величиной концентрации билирубина).

