Как получить цинк?
Металлический цинк впервые был получен в XVIII в. Хотя сказать «впервые» было бы неправильно. Известно, что цинк получали в Индии еще в V в. до н. э., а в Персии – в XIII в… Но рецепт не дошел до европейских химиков, а попытки выплавить его из цинковой руды оказывались безуспешными. В чем причина? Ведь по распространенности в земной коре цинк превосходит и ртуть, и олово, и свинец. Однако все эти металлы научились получать в незапамятные времена, а первый патент на производство цинка был получен молодым британским металлургом Уильямом Чемпионом только в 1738 г.
Дело в том, что обычный способ выплавки цветных металлов – это обжиг сульфидных руд с последующим восстановлением углем металла из оксида. Цинк встречается в природе в минерале сфалерите, или цинковой обманке, в виде сульфида цинка ZnS. Обычно этот минерал сопутствует галениту (свинцовому блеску PbS) и сульфидам других цветных металлов, то есть входит в состав полиметаллических руд. При обжиге сульфид цинка, как и сульфиды других цветных металлов, превращается в оксид:
Как и другие цветные металлы, цинк восстанавливается из оксида углем:
Для этого нужна температура 110 °C°. Но, в отличие от других цветных металлов, цинк кипит при температуре 906 °C! То есть восстановленный цинк возгоняется и сгорает в воздухе, снова образуя оксид цинка. Собрать его не удавалось, пока Чемпион не догадался проводить восстановление в герметичных огнеупорных ретортах без доступа воздуха. Так, вероятно, и действовал герой рассказа. В настоящее время к пирометаллургическому (от греческого πῦρ – «огонь») способу Чемпиона добавился гидрометаллургический. Полученный при обжиге руды оксид цинка растворяют в кислоте:
ZnO + H2SO4 = ZnSO4 + H2O
Образовавшийся раствор соли цинка далее подвергают электролизу. На катоде восстанавливается цинк:
2ZnSO4 + 2H2O = 2Zn + O2 + 2H2SO4
Но этот способ по известным причинам герою рассказа недоступен: у него пока нет источника тока.
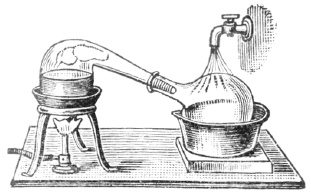
Как получить азот?
Об азоте впервые человечество узнало только в XVIII в. В 1772 г. эксцентричный английский ученый Генри Кавендиш (открывший, кстати, и водород) проводил опыт с воздухом. Он пропускал воздух над раскаленным углем, а затем через раствор щелочи. Мы сегодня понимаем, что кислород воздуха соединялся с углем, образуя углекислый газ, который затем поглощался щелочью:
С + О2 = СО2
СО2 + 2NaOH = Na2CO3 + H2O
После этих процедур оставался бесцветный газ, который Кавендиш назвал «удушливым воздухом» (в тот период развития науки любое газообразное вещество еще считали разновидностью воздуха). Наш герой вполне мог воспользоваться этим способом для выделения азота из воздуха.
Но герой рассказа предпочел поначалу получить азот из аммиачной селитры. До открытия аммиачной селитры Иоганном Рудольфом Глаубером оставалось четыре года! Считают, что впервые она была получена в 1659 г. Это означает, что все необходимые для этого вещества и методы науке уже были известны. Глаубер получил ее, скорее всего, действуя аммиаком на азотную кислоту. Сначала Глаубер усовершенствовал способ получения азотной кислоты. До него азотную кислоту веками получали нагреванием смеси селитры и железного купороса. Глаубер заменил купорос купоросным маслом, то есть концентрированной серной кислотой:
2NaNO3 + H2SO4 = 2НNO3 + Na2SO4
Пары азотной кислоты отгонялись и конденсировались. Далее на азотную кислоту нужно подействовать аммиаком:
Ученым, открывшим аммиак, считается Джозеф Пристли. Это произошло в 1774 г. Но аммиак был известен и ранее. Его получали из соли аммония (хлорида аммония, или нашатыря) действием щелочей.
Герой рассказа вполне мог получить азотную кислоту по методу Глаубера, поскольку концентрированную серную кислоту он получил, а раздобыть селитру в середине в XVII в. не было проблемой, ведь черный порох, содержащий селитру, известен в Европе с XIV в. Для получения аммиака нужны нашатырь и гашеная известь:
2NН4Cl + Са(ОН)2 = СаCl2 + 2NН3 + 2Н2О
Перечень операций, который приводится в рассказе, не вполне соответствует описанным реакциям. Не совсем понятно, что следует понимать под намерением «восстановить селитру». Если под восстановлением понимается кипячение селитры в концентрированном растворе щелочи с добавлением цинка (цинк уже получен!), то продуктом восстановления будет аммиак. Аммиак нам нужен. Значит, нашатырь уже доставать не требуется.
NaNO3 + 8Ho (Zn, конц. NaOH) = NН3 + 2Н2О + NaOH
Уравнение реакции показывает, что цинк реагирует со щелочью с выделением атомарного водорода, который восстанавливает нитрат-ион до аммиака.
А что с азотной кислотой? В рассказе предлагается «добавить туда серной кислоты». Возможно, имеется в виду добавление серной кислоты к селитре. Хорошо, так мы получим азотную кислоту. И последнее – «нейтрализовать аммиаком» – уже понятно. Перекристаллизация – способ выделения растворимого кристаллического вещества из раствора при его охлаждении.
Но вернемся к азоту. Как аммиачная селитра поможет его получить? Разложением. Беда только в том, что при разложении нитрата аммония протекают одновременно разные реакции. При температуре в пределах 200 °C основным продуктом будет закись азота, или «веселящий газ» N2О.
Тоже неплохо, если ставить задачу позабавить публику. В XVII в. веселящий газ еще неизвестен, откроет его только в 1772 г. Джозеф Пристли. Повторив опыты Пристли, Гэмфри Дэви обнаружил, что вдыхание этого газа улучшает настроение и вызывает эйфорию. На своих лекциях Дэви демонстрировал действие веселящего газа желающим из публики, и лекции эти были чрезвычайно популярны.
Но у героя рассказа другая задача – наполнить колбу электрической лампочки химически инертным газом. И тут закись азота не годится: тлеющая лучинка вспыхивает в ней не хуже, чем в кислороде, и нить накаливания тоже мгновенно перегорит. Нужен азот. Ну, что ж, азот тоже может получиться при разложении нитрата аммония, только при нагревании свыше 300 °C:




