Мембраны ионных градиентно-зависимых АТФ-синтаз представляют собой удивительный молекулярный «электродвигатель», роторный мотор, который переводит ионный градиент в механическую энергию вращения, а затем в химическую энергию β-γ-фосфодиэфирной связи АТФ. Анализ методами сравнительной геномики заставляет предположить, что предки двух основных ветвей мембранных АТФаз/синтаз, так называемые F-АТФазы, как правило обнаруживаемые в бактериях (и в эндосимбиотических органеллах эукариот), и V-АТФазы, характерные для архей и эндомембранных систем эукариот, произошли от общего предка, который функционировал как транслоказа белков или РНК (Mulkidjanian et al., 2007).
В предложенном эволюционном сценарии стадия транслоказы предваряет расхождение ветвей бактерий и архей, но мембранные АТФ-синтазы как таковые существенно различаются у архей и бактерий и, возможно, возникли дважды, независимо в разных ветвях клеточной жизни. Эти аналогии позволяют устремиться еще дальше в доклеточное эволюционное прошлое и предположить происхождение этой древней транслоказы от РНК-геликазы и мембранной поры или канала (см. рис. 11-3). Реконструкция эволюции мембранной АТФ-синтазы является основой для определения последовательности доклеточной эволюции: широкая диверсификация ферментов, содержащих петлю связывания фосфата (P-loop; см. гл. 12), которая породила, кроме множества АТФаз, еще и отдельное семейство РНК-геликаз (включающих бактериальный фактор терминации транскрипции Rho), произошла еще до развития мембранной энергетики, по крайней мере в той ее форме, которая наблюдается в современных клетках.
Весьма привлекательной кажется мысль о том, что, возможно, древнейшие вирусные мембраны могли быть промежуточными шагами в эволюции биологической компартментализации, что относит вглубь по исторической шкале время появления полноценных клеточных мембран. Действительно, в эволюции современных сложных мембран есть парадокс. Мембраны всех современных клеток являются исключительно изощренными устройствами: двойной липидный слой непроницаем даже для небольших молекул, а перенос молекул между внутриклеточным пространством клетки и внешним миром происходит при помощи мембранных белковых комплексов, таких как каналы, поры, транслоказы и вышеупомянутые градиент-зависимые АТФазы, ответственные за клеточную энергетику. Мембрана — это еще одна сложнейшая система, понимание происхождения которой сталкивается с классической дарвиновской проблемой: жизнеспособные промежуточные стадии сложно себе представить. «Дырявая» мембрана не может обеспечить целостность клеточного содержимого, в то время как непроницаемая мембрана будет бесполезна, поскольку не позволит импортировать строительные блоки для репликации. Вирусоподобные частицы могут разрешить этот парадокс, поскольку они получают выгоду от непроницаемой мембраны, если вирион снабжен транслоказой нуклеиновой кислоты
[121]. Подобно тому как репликацию генома вирусоподобных объектов можно рассматривать как изначальный полигон для отработки репликационных стратегий, две из которых впоследствии были вовлечены в две основных линии клеточной жизни, вирусные частицы могли быть «лабораторией» для отработки молекулярных устройств, которые в дальнейшем встроились в мембраны развивающихся клеток.
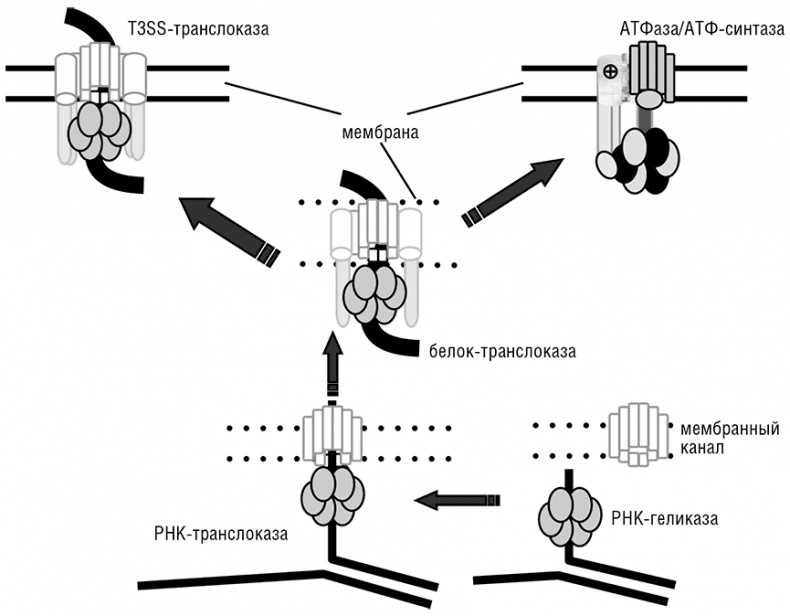
Рис. 11-3. Модель эволюции молекулярных моторов и мембранной биоэнергетики: от РНК-геликазы и мембранного канала к РНК-белковой транслоказе, и далее к ионно-градиентной АТФ-синтазе. Сплошные линии показывают современные непроницаемые для ионов мембраны, прерывистые линии показывают гипотетические «протекающие» древние мембраны. Изогнутая стрелка показывает утечку катионов из клетки. T3SS — система секреции типа 3, белковая транслоказа, распространенная у современных бактерий. В белковых транслоказах центральную позицию временно занимает перемещаемый белок, в то время как в мембранных АТФазах эту позицию занимают соответствующие белковые субъединицы. Сценарий эволюции взят из Mulkidjanian et al., 2007.
От отбора генных ансамблей прямая дорога к отбору содержимого ячеек, когда ячейки, поддерживающие быструю репликацию, «заражают» смежные ячейки и фактически распространяют свои коллективные «геномы»; первичные вирусоподобные частицы могли содействовать этому процессу (Koonin and Martin, 2005). Доклеточный эквивалент ГПГ — перенос генетического содержимого между ячейками — тоже часть этой модели, в согласии с идеей о том, что массовый ГПГ был неотъемлемой частью ранней стадии эволюции жизни. После того как в ходе эволюции эгоистичных кооператоров в сети неорганических ячеек был достигнут определенный уровень сложности, стал возможен «побег» протоклеточных организмов, имеющих сравнительно большие ДНК-геномы и мембраны, содержащие механизмы транспорта и транслокации (изначально развившиеся, согласно модели, в вирусоподобных агентах). Нельзя сказать, как много подобных попыток провалилось моментально и сколько продержалось дольше, но только археи и бактерии (согласно симбиотическому сценарию более позднего возникновения эукариот, как описано в гл. 7) дожили до сегодняшнего дня. Первый успешный «побег» клеточной жизни из гипотетического доклеточного «супа» соответствует дарвиновскому порогу клеточной эволюции, описанному Вёзе, — порогу, за которым ГПГ должен был существенно сократиться и начаться эволюция отдельных линий (видов) клеточных организмов (Woese, 2002).
Как и в других моделях ранних стадий эволюции биологической сложности и, возможно, даже более явно, сценарий «первобытного вирусного мира», описанный здесь, сталкивается с проблемой победы эгоистичных элементов. В главе 10 мы говорили о том, что появление паразитов — черта, присущая любой эволюционирующей системе репликаторов. Если бы первобытные паразиты стали слишком агрессивными, они могли бы уничтожать своих хозяев внутри ячейки и далее выживать, только инфицируя следующую ячейку (где они снова представляли бы опасность). Можно вообразить разрушительную «пандемию», прокатившуюся по всей сети и уничтожившую все ее содержимое, и, скорее всего, именно такой была судьба многих, если не большинства, первобытных «организмов». Примечательно, что математическое моделирование репликаторов заставляет предполагать, что важной движущей силой, определившей появление ДНК, которая привела к разделению роли матрицы и катализаторов на доклеточной стадии эволюции, могла быть повышенная сопротивляемость паразитов в системах со специализированными, выделенными матрицами (Takeuchi et al., 2011). Условием для выживания доклеточных форм жизни было, во-первых, появление умеренных паразитов, которые не убивали хозяина, и, во-вторых, эволюция защитных механизмов, вероятнее всего основанных на РНК-интерференции. Повсеместное распространение умеренно эгоистичных элементов и защитных систем, основанных на РНК-ин терференции, во всех ветвях клеточной жизни наводит на мысль, что эти явления появились на очень ранней, даже, возможно, доклеточной стадии эволюции.



