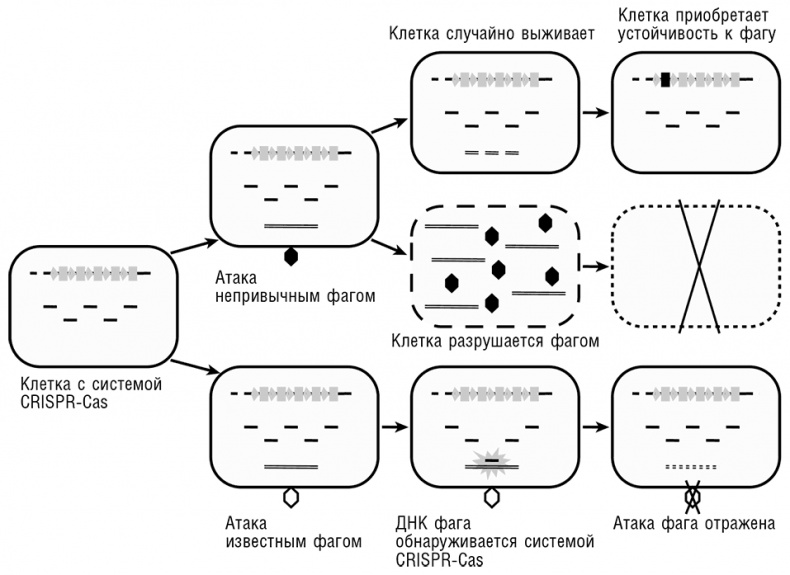
Рис. 9-2. Система CRISPR-Cas и механизм ее действия как пример ламарковской эволюции. Заимствовано из Koonin and Wolf, 2009b.
Механизм наследственности и эволюции генома, реализованный в CRISPR-Cas системе, представляется в полной мере ламарковским (см. рис. 9-2).
• Стимул из внешней среды (эгоистичный генетический элемент, такой как вирус) используется для непосредственного изменения генома.
• Возникающая модификация (уникальный элемент-специфичный спейсер) напрямую влияет на фактор, вызвавший изменение.
• Модификация явно адаптивна и наследуется потомками клетки, столкнувшейся с эгоистичным элементом.
CRISPR-опосредованная наследственность, по-видимому, не очень устойчива: даже близкородственные геномы архей и бактерий не содержат одинаковых вставок. Подразумевается, что, как только бактерии или археи перестают сталкиваться с конкретным агентом (вирусом), соответствующие спейсеры быстро вырождаются. В самом деле, вставки вряд ли могут быть эволюционно стабильными в отсутствие сильного селективного давления, поскольку единственная мутация сразу делает их бесполезными. Кроме того, во многом подобно адаптивной иммунной системе у животных, CRISPR-системы в редких случаях демонстрируют свойство аутоиммунности: спейсеры, идентичные фрагментам обычных генов клетки-хозяина, вставляются в CRISPR-кассеты и, предположительно, нарушают экспрессию соответствующих генов (Stern et al., 2010). Несмотря на некоторую эфемерность наследственности CRISPR, ее ламарковский характер неоспорим: адаптивная эволюция организмов происходит непосредственно в ответ на внешний фактор среды и результатом является конкретная адаптация (резистентность) к данному специфическому фактору
[92].
Другие (квази)ламарковские системы, функционирующие по принципу CRISPR
Интересно и поучительно сравнить особенности наследственности и эволюции в случае CRISPR-системы с соответствующими характеристиками эукариотической РНК-интерференции (RNAi) и, в частности, малых интерферирующих (si) РНК и PIWI-взаимодействующих (pi) РНК, то есть с защитными системами эукариот, в общих чертах функционально аналогичными CRISPR. Для начала вспомним примечательный и довольно загадочный факт: белковый аппарат эукариотической РНК-интерференции не гомологичен Cas-белкам; белковые компоненты этой сложной эукариотической системы были собраны из прокариотических доменов, которые первоначально были вовлечены в исполнение других функций (см. гл. 7; Shabalina and Koonin, 2008). Очевидное отсутствие ортологов для любого из Cas-белков в клетках эукариот позволяет предположить, что эта система каким-то образом исключена из эукариотического мира отбором, хотя лежащее в основе селективное давление представляется смутно. Единственным намеком может служить общая причина утраты оперонов у эукариот, которую мы обсуждали в главе 7: опероны исчезают под действием рекомбинационного храповика, и гены, которые требуют особенно тесной координации экспрессии или же вредны вне контекста действия оперона, устраняются путем очищающего отбора
[93].
В отличие от CRISPR-Cas, системы РНК-интерференции не используют механизм Ламарка напрямую. Тем не менее они явно демонстрируют характерные «ламарковские» черты. Система siРНК (отдельный вид РНКи) «обучается» внешним агентом (вирусом) путем генерации малых интерферирующих РНК, комплементарных вирусным генам (Kim et al., 2009). Этот процесс, безусловно, имеет сходство с CRISPR-механизмом, но, кроме того, напоминает, по крайней мере метафорически, «изменение повадок» по Ламарку. Более того, система имеет некоторый уровень памяти, поскольку во многих организмах миРНК амплифицируются, и устойчивость к соответствующему вирусу может сохраняться в течение нескольких поколений (Ding, 2010). Подобная стабильность миРНК служит одним из проявлений получающего все более широкое признание РНК-опосредованного наследования, которое иногда называют парамутацией (Hollick, 2010). Ключевое отличие от CRISPR состоит в том, что (насколько известно в настоящее время) миРНК не записываются в геном, так что здесь имеет место лишь эпигенетическая наследственность ламарковского типа, но не полноценная генетическая наследственность.
Однако даже это различие размывается в случае piРНК, которые являются производными транспозонов. Это наиболее распространенные малые РНК в животном мире, образующие быстро растущие геномные кластеры, обеспечивающие защиту от мобильных элементов в зародышевой плазме (Bourc’his and Voinnet, 2010). В случае этих малых РНК, как и в ситуации с CRISPR, фрагменты генома мобильного элемента интегрируются в геном хозяина, где они быстро размножаются, видимо, под давлением отбора на эффективную защиту (Assis and Kondrashov, 2009). Такая система, похоже, отвечает всем критериям наследования приобретенных признаков и ламарковского режима эволюции. Здесь особенно примечательно, что изолированная зародышевая плазма, будучи важнейшим изобретением многоклеточных эукариот, которые, по-видимому, блокируют некоторые формы (квази)ламарковского наследования, такие как горизонтальный перенос генов (см. обсуждение далее в этой главе), сама выработала в процессе эволюции особую версию механизма ламарковского типа.
Целый ряд примечательных данных по растениям и животным, полученных совсем недавно, указывает на то, что эукариоты используют обратную транскрипцию для интеграции ДНК-копий генома РНК вирусов в хромосомы и могут затем использовать эти встроенные последовательности для производства миРНК или белков, обеспечивающих устойчивость к соответствующим вирусам (Feschotte, 2010; Horie et al., 2010; Koonin, 2010c). Эти механизмы еще предстоит исследовать более тщательно, но по идее они должны быть аналогичны CRISPR и, следовательно, являются ламарковскими.



