Это название пошло от важного класса химических реакций, открытого и объясненного теоретически в 1930-х годах Н. Н. Семеновым и его учениками Ю. Б. Харитоном, Я. Б. Зельдовичем и Д. А. Франк-Каменецким (отцом автора этих строк). Хотя экспоненциальный рост был к тому времени хорошо изучен в биологии, цепные химические реакции были новостью. За их открытие Семенов был удостоен в 1956 году Нобелевской премии по химии. Цепная реакция объяснила явление теплового взрыва, происходящего при использовании обычных взрывных зарядов. Она оказалась столь же важной для проектирования ядерных реакторов и атомной бомбы. Именно из-за шума вокруг атомной бомбы термин «цепная реакция» вошел в обиход и теперь, к месту или не к месту, используется повседневно.
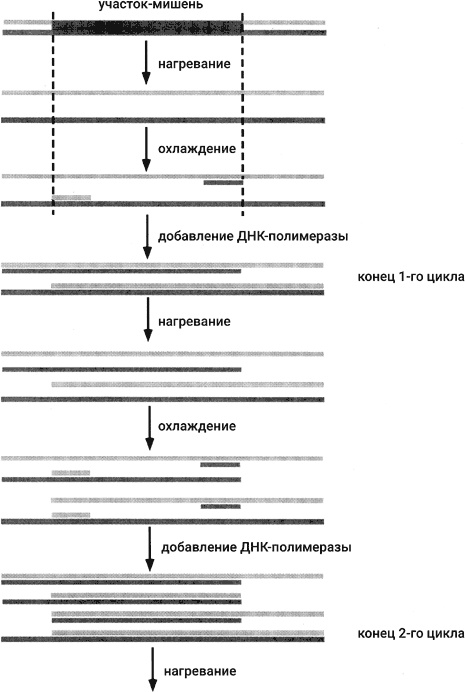
Рис. 44. Три цикла полимеразной цепной реакции (ПЦР)
Итак, феномен жизни можно рассматривать как ДНКовую цепную реакцию. Эта цепная реакция протекает в контролируемом режиме (подобно цепной реакции в ядерном реакторе), при котором рождаемость примерно уравновешивается смертностью и количество особей остается более или менее постоянным. Но иногда ДНКовая цепная реакция напоминает взрыв: это происходит при эпидемиях заразных болезней.
Сразу же после открытия химических цепных реакций стала ясна аналогия между ними и размножением живых существ. Цепной характер размножения ДНК был очевиден сразу после открытия двойной спирали. Поразительно, что вплоть до середины 1980-х годов никто не пытался осуществить ДНКовую цепную реакцию в пробирке, хотя все для этого уже было. Плавление ДНК (т. е. разделение комплементарных цепей при нагревании) было к тому времени детально изучено. Синтез ДНКовых праймеров уже стал рутинным делом. Удлиняющая праймеры ДНК-полимераза I была общедоступна и широко использовалась (см. главу 5). Молекулярным биологам просто не приходило в голову, с какой стати они стали бы размножать ДНК в пробирке. В одной из своих статей Корана упомянул, что ДНКовая цепная реакция может быть осуществлена путем периодического нагревания и охлаждения образца ДНК в присутствии праймеров и четырех дНТФ при помощи ДНК-полимеразы I. Ну и что? Корана не собирался тратить время, чтобы доказывать кому-то, что такая цепная реакция действительно возможна. Разумеется, возможна! Какие могут быть сомнения?
Скорее всего, Кари Мулис не читал статью Кораны. Мулис работал в одной из биотехнологических компаний, которые стали расти как грибы после дождя в конце 1970-х и в начале 1980-х годов. Работая в биотехе, а не в научном институте, Мулис ясно осознавал, что возможность размножать ДНК в пробирке может привести к подлинной революции в биотехнологии. Он был настолько захвачен идеей о ПЦР, что ему удалось заразить своим энтузиазмом коллег по компании и убедить их поставить опыты. Схема их первых опытов показана на рис. 44.
Прежде всего выбиралась ДНКовая мишень для размножения. Необходимо было знать последовательность оснований в выбранной мишени, по крайней мере концевые последовательности. Затем синтезировали два праймера. Один из них был комплементарен нижней цепи ДНК на левом конце мишени; второй был комплементарен верхней цепи ДНК на правом конце мишени. Оба праймера примешали к образцу в большом избытке по отношению к ДНК-мишени. (ПЦР может быть осуществлена, даже когда в образце исходно находится одна молекула ДНК-мишени.) Также в образце находились в достаточном количестве все четыре дНТФ. После этого образец нагревался до температуры, гарантировавшей плавление ДНК-мишени (т. е. разделение комплементарных цепей). Затем образец вновь охлаждали. В ходе охлаждения синтетические праймеры связывались с комплементарными участками на разделенных цепях мишени, в то время как взаимно комплементарные цепи исходной ДНК-мишени не могли найти друг друга, так как они присутствовали в образце в ничтожно низкой концентрации.
Итак, в результате охлаждения получились два субстрата для реакции удлинения праймера (см. главы 5 и 7). Следовательно, добавление к образцу ДНК-полимеразы I приводило к удлинению двух праймеров навстречу друг другу. Так появлялись две дочерние молекулы. Они частично состояли из двух цепей, но содержали длинные одноцепочечные хвосты. Существенно, что последовательность-мишень была полностью двухцепочечной. Последующие циклы нагревания / охлаждения / добавления полимеразы приводили к синтезу все новых молекул, и у всех них участок-мишень был двухцепочечным.
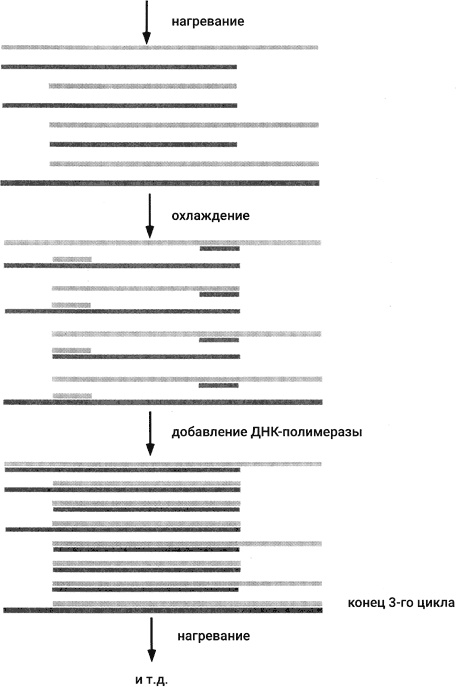
Как видно из рис. 44, молекулы, состоящие исключительно из последовательности-мишени, появляются только в третьем цикле. В ходе дальнейших циклов их количество растет экспоненциально. Восемь таких молекул образуется на 4-м цикле, 32 738 – на 15-м и миллиард на 30-м. В ходе своих первых опытов Мулис и его коллеги не могли делать так много циклов. Основная проблема состояла в инактивации фермента при нагревании, так что порции свежего фермента приходилось добавлять вновь и вновь в каждом цикле.
Важнейшее усовершенствование, сделавшее ПЦР столь потрясающим методом, состояло в замене ДНК-полимеразы I так называемой Taq-полимеразой. Выделенная и термофильных бактерий, живущих в горячих источниках, Taq-полимераза легко выдерживает нагревание до 94 °C. При такой температуре цепи ДНК расходятся. Taq-полимераза лучше работает в горячих условиях, так что с ее помощью реакцию удлинения праймера ведут при 72 °C.
Использование Taq-полимеразы позволяет проводить ПЦР в полностью автоматизированном режиме, используя простой робот, называемый термоциклером или ПЦР-машиной. В обычной пробирке смешивают ДНК-мишень, четыре дНТФ и Taq-полимеразу в соответствующем буфере, содержащем необходимые ионы металлов. Затем пробирку помещают в термоциклер, который программируется на изменение температуры по следующей схеме: нагрев до 94 °C и выдерживание при этой температуре 1 минуту; охлаждение до 60 °C и выдерживание при этой температуре 1 минуту (на этом этапе праймеры связываются с комплементарными участками на концах мишени); нагрев до 72 °C и выдерживание при этой температуре 1 минуту для проведения реакции удлинения праймера при оптимальной температуре для Taq-полимеразы. Затем термоциклер начинает новый цикл по той же схеме (подъем температуры до 94 °C и т. д.). Затем еще цикл и еще цикл, сколько пожелает оператор.
Одна из многих замечательных особенностей ПЦР состоит в том, что вам не нужно очищать мишень от примеси чужеродной ДНК. Праймеры строго отберут только истинную мишень для размножения, даже если она представлена всего в одном-единственном экземпляре на фоне громадного избытка других молекул ДНК. Отметим также, что в отличие от живой природы, где размножение линейных молекул ДНК сопряжено с серьезным проблемами (см. главу 7), в случае ПЦР проблемы концов не возникает из-за того, что используются синтетические ДНКовые праймеры, а не РНКовые праймеры, как при репликации ДНК в клетке. Выбирая число циклов ПЦР, вы можете получить столько копий молекулы-мишени, сколько пожелаете (точнее, пока не исчерпаете дНТФ или праймеры).




