Сейчас поиск новых лекарств в значительной мере отличается от того, что было вчера, а завтра, благодаря фармакогеномике, он должен стать еще более эффективным и точным (рис. 36).
Началось все с «трудов» средневековых алхимиков, когда они пытались найти и создать элексир вечной молодости. Поиск шел в природе, в ее естественных продуктах. Один из подходов, применяемых в недалеком прошлом и не потерявших свою актуальность даже сейчас, — использование в качестве лекарственных средств тех естественных продуктов человеческих клеток, которые способны сами защищать организм от всевозможных патологий. Таких «защитников» довольно много в нашем организме, но не всегда их хватает для борьбы с патологическими процессам. Можно использовать не сами белки-защитники, а некие их усовершенствованные формы. Примером этому может служить путь, по которому шли российские ученые во главе с членом-корреспондентом РАН Н. Ф. Мясоедовым при создании уникального медицинского препарата «Семакс». По своим свойствам — это нейропептид. Обычно нейропептиды вырабатываются клетками нервной ткани и представляют собой, как правило, короткие аминокислотные последовательности, которые обладают высокой эффективностью и выраженной направленностью действия даже при условии их очень малой концентрации. «Семакс» был создан в результате анализа действия различных производных адренокортикотропного гормона на такие фундаментальные функции мозга, как обучение и память. Выяснилось, что пептид, состоящий всего из четырех аминокислот, входящих в состав этого естественного гормона человека, вмешиваясь в нарушенное управление больной клетки, способен восстанавливать ее нормальное состояние. Далее на один из концов этого пептида были искусственно добавлены три специфические аминокислоты, которые защищают его от быстрого разрушения в организме. И в результате появился медицинский препарат нового поколения, который сейчас все шире и шире используется в медицинской практике при лечении травм головного мозга, инсульта и расстройств памяти.
Еще недавно большим достижением считалось «плясать» от конкретного гена. И действительно, это стало весьма важным этапом на пути создания эффективных лекарственных средств.
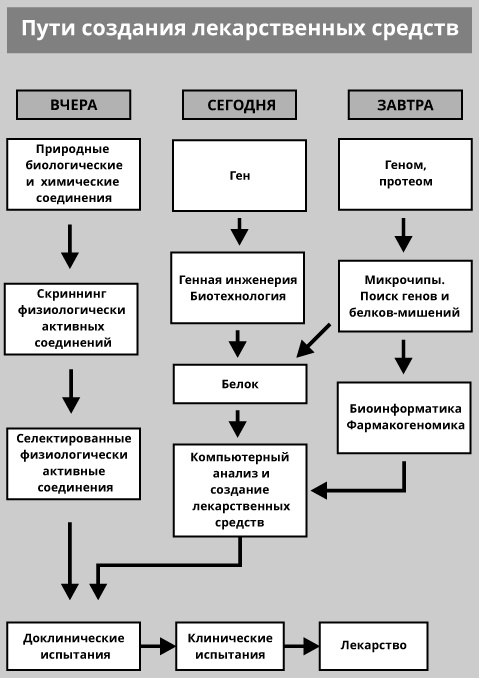
Рис. 36. Схема, иллюстрирующая в общем виде эволюцию основных путей создания лекарственных средств
Но теперь основные эффективные пути поиска новых лекарственных средств уже базируются на знаниях о полной структуре генома человека, с переходом на знания о структуре всех белков человека (его протеома). Секвенированный геном человека стал «путеводной книгой» для фармацевтических компаний. Появилась, как иногда говорят, «единственная в жизни» возможность идентифицировать все человеческие гены-мишени. Это одна из основных причин, почему вокруг нее ведутся жаркие баталии между двумя основными исполнителями проекта «Геном человека». За все времена до секвенирования генома человека было определено лишь около 500 молекулярных мишений, на которые направлено действие лекарственных веществ. Теперь, благодаря успехам в геномике человека, ожидается десятикратное увеличение таких мишений (по разным оценкам, общее их число у человека может составлять от 5000 до 10000).
Фармакогеномика осуществляет поиск новых мишений на базе двух китов — секвенированной нуклеотидной последовательности ДНК человека и компьютера. Подробнее мы поговорим об этом в главе по биоинформатике. Здесь отметим лишь несколько подходов.
Среди новых генов, обнаруженных в ходе полного секвенирования генома, сейчас осуществляют активный поиск тех, которые имеют структурное сходство с ранее выявленными генами- и белками-мишенями. Например, известной мишенью для лекарств являются белки, обладающие свойствами протеаз, — ферментов, расщепляющих другие белки. Сейчас уже предсказано существование у человека около 1000 белков с такими свойствами (вот и 1000 новых потенциальных мишеней!).
Другой подход — анализ все тех же уже многократно упоминавшихся снипсов. Изучение вариаций в геноме позволяет осуществлять направленный поиск генов, ответственных за определенные заболевания человека, которые ранее не рассматривались как гены-мишени.
С помощью компьютеров осуществляют также отбор среди имеющихся в распоряжении человека миллионов различных химических соединений тех, которые способны специфически взаимодействовать с определенными белками-мишенями, определяющими развитие того или иного заболевания.
Важнейшее направление в фармакогеномике — перевод медицины на рельсы персонифицированного лечения. К настоящему времени уже накопилось большое количество информации о генах, которые влияют на процессы всасывания, распределения, метаболизма и выведения лекарственных средств. В связи с полиморфизмом таких генов у некоторых пациентов лекарственные препараты могут быть неэффективными или даже оказывать токсическое воздействие. Известно, например, что в норме у различных групп исследуемых людей скорость удаления (элиминации) лекарства из организма может отличаться от 4 до 100 раз. Одним из комплексов генов, определяющих метаболизм лекарственных препаратов, являются гены системы цитохрома Р450. Скорость метаболизма лекарств у людей с разными изменениями этих генов отличается в сотни раз. Это указывает на то, что у отдельных индивидуумов возможно развитие побочных реакций в ответ на прием лекарственных препаратов даже в обычных (официально рекомендованных) дозах.
По данным Американской медицинской ассоциации, в США в 1994 году развитие побочных реакций явилось причиной госпитализации 2 млн. человек. В настоящее время почти семи миллионам американцев в возрасте 65 лет и старше прописываются лекарства, которые им не совсем подходят. Хуже того, по мнению экспертов, около одного миллиона проглоченных ими таблеток им вообще не следовало бы принимать. В последние годы побочные реакции на прием лекарственных препаратов постоянно занимают 4-е — 6-е место среди причин смерти в США. По некоторым оценкам, из-за неблагоприятных реакций на сильнодействующие лекарственные средства ежегодно в мире умирают до 100 тыс. человек.
Важное значение для решения этих проблем имеет изучение особенности структуры не только генов, детерминирующих метаболизм лекарственных средств, но и ряда других, на первый взгляд, совершенно незначительных различий, которые имеются в геномах разных индивидуумов. В частности, восприимчивость и реакция человека на те или иные лекарства в ряде случаев тесно связана с уже упоминавшимися снипсами. Так же, как эти «незначительные» вариации в геноме определяют разницу в подверженности людей к определенным видам заболевании, с ними зачастую ассоциированы и различия в результатах, наступающих у конкретного человека после принятия определенного лекарства. Приведем один пример. Астматики часто используют лекарство албутерол, который взаимодействует с рецептором адреналина и подавляет приступ удушья. Однако из-за разнообразия гаплотипов людей лекарство действует не на всех, а некоторым больным оно вообще противопоказано. Выяснилось, что это связано со снипсами в одном из генов: люди с последовательностью букв ТЦТЦЦ не реагируют на албутерол, если же концевой цитозин заменен на гуанин (ТЦТЦГ), то реакция есть, но частичная. Для людей же с тимином вместо концевого цитозина в этом участке — ТЦТЦТ — лекарство токсично!



