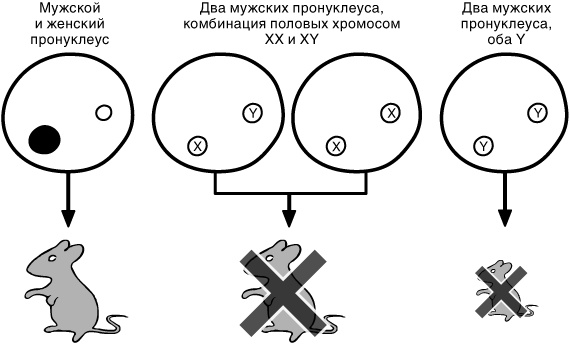
Рис. 9.3. В экспериментах по воссозданию донорской яйцеклетки в нее вводились мужской и женский пронуклеусы или два мужских пронуклеуса. Как было показано и на рисунке 7.2, эмбрионы, полученные из двух мужских пронуклеусов, оказались неспособны развиться полностью. Когда в каждом из ядер содержалось по одной хромосоме Y и не было ни одной хромосомы X. развитие эмбрионов приостанавливалось развитие на очень ранней стадии. Эмбрионы, полученные из двух мужских пронуклеусов, из которых хотя бы один содержал хромосому X, развивались несколько дольше, но в итоге тоже погибали
На самой ранней стадии развития погибали эмбрионы, созданные из двух мужских пронуклеусов, каждый из которых содержал хромосому Y как единственную половую хромосому
[100]. В таких эмбрионах хромосомы X не было вообще, и именно это стало причиной их гибели на самом раннем этапе развития. Этот эксперимент подтверждает тот факт, что хромосома X чрезвычайно важна для жизнеспособности организма. Вот почему мужские (XY) клетки должны уметь «считать», так как только при этом условии они смогут понять, что располагают лишь одной хромосомой X, и не станут подавлять ее. Для клетки репрессия единственной хромосомы X будет иметь катастрофические последствия.
После подсчета количества хромосом X в женских клетках должен включиться другой механизм, случайным образом выбирающий одну из хромосом X для репрессии. Выбрав хромосому, клетка начинает ее подавлять.
Репрессия хромосомы X происходит на ранних стадиях развития женского эмбриона, когда клетки внутриклеточной массы начинают дифференцироваться на клетки разных типов. Экспериментально очень сложно работать с довольно небольшим числом клеток, которые можно получить из бластоцисты, поэтому исследователи обычно пользуются женскими ЭС клетками. В этих клетках обе хромосомы X активны, как и во внутриклеточной массе периода, предшествующего дифференциации. ЭС клетки довольно легко скатить вниз по уоддингтоновскому эпигенетическому ландшафту, для этого всего лишь нужно чуть изменить условия, в которых эти клетки выращиваются в лаборатории. Как только мы изменим эти условия, подталкивая женские ЭС клетки к дифференциации, они тут же начнут подавлять хромосому X. Так как ЭС клетки могут выращиваться в лабораториях практически в неограниченных количествах, они представляют собой очень подходящую модельную систему для изучения репрессии хромосомы X.
Создание картины категории X
Проникать в загадки репрессии хромосомы X мы начали при изучении мышей и линий клеток со структурно перестроенными хромосомами. В некоторых из этих исследований обнаруживалось, что различные участки хромосомы X оказывались утрачены. В зависимости от того, каких именно участков недоставало, хромосома X активировалась или подавлялась. В ходе других исследований выяснилось, что некоторые участки отделялись от хромосомы X и присоединялись к какой-либо аутосоме. Это могло привести к удалению структурно аномальной аутосомы, опять же в зависимости от того, какая часть хромосомы X меняла свое местоположение
[101]
[102].
Эти эксперименты показали, что на хромосоме X есть определенный участок, который жизненно важен для ее репрессии. Эта область была названа центром репрессии X. В 1991 году группа ученых лаборатории Ханта Уилларда из Стэнфордского университета в Калифорнии обнаружила, что в центре репрессии X содержится ген, который они назвали Xist (аббревиатура от X-inactive (X) specific transcript, то есть Х-репрессированный специфический транскрипт)
[103]. Этот ген экспрессировался только с подавленной хромосомы X, но никогда — с активной. Так как ген экспрессировался лишь с одной из двух хромосом X, он становился привлекательным кандидатом на роль контроллера репрессии хромосомы X, при которой две идентичные хромосомы вели себя неодинаково.
Неоднократно предпринимались попытки идентифицировать белок, кодируемый геном Xist
[104], но в 1992 году стало ясно, что с ним происходит нечто странное. Ген Xist транскрибировался для образования копий РНК. Эта РНК обрабатывалась так же, как любая другая РНК. Она сплайсировалась, и различные структуры добавлялись к каждому концу транскрипта для повышения ее стабильности. Пока все соответствует норме. Но прежде чем молекулы РНК начинали кодировать белок, они должны были покинуть ядро и проникнуть в цитоплазму клетки. Происходит так по той причине, что рибосомы — внутриклеточные структуры, соединяющие аминокислоты в длинные белковые цепочки — присутствуют только в цитоплазме. Но Xist РНК никогда не покидал ядра, а это означало, что он и не мог продуцировать белок
[105]
[106].
Это, по крайней мере, прояснило один вопрос, озадачивавший ученый мир с момента обнаружения гена Xist. Взрослая Xist РНК представляет собой длинную молекулу, насчитывающую почти 17000 пар оснований (17 т. п. о.). Одна аминокислота кодируется состоящим из трех пар оснований кодоном, о чем уже говорилось в главе 3. Таким образом, теоретически, 17000 пар оснований должны быть способны закодировать белок длиною в 5700 аминокислот. Но когда исследователи проанализировали последовательность Xist с помощью рассчитывающих белки программ, они просто не могли понять, как он может закодировать нечто настолько длинное. На протяжении всей последовательности Xist обнаружились терминирующие кодоны (которые сигнализируют о завершении продукции белка), а самый длинный расчетный участок без терминирующих кодонов мог закодировать лишь 298 аминокислот (894 пары оснований
[107]). По какой причине эволюция породила ген, создающий транс крипт в 17 т. п. о., но использующий для кодирования белка только около 5 процентов своего потенциала? Это выглядит как очень нецелесообразное расходование энергии и ресурсов клетки.
Но так как Xist на самом деле никогда не покидает ядра, его неспособность эффективно кодировать белки в данном случае не имеет значения. Xist не выступает в роли матричной РНК (мРНК), кодирующей белок. Он принадлежит к классу молекул, которые называются некодирующими РНК (нкРНК). Xist может не кодировать белок, но это не значит, что он освобожден от каких-либо обязанностей. Напротив, Xist нкРНК сама действует как функциональная молекула, имеющая критическое значение для репрессии хромосомы X.



