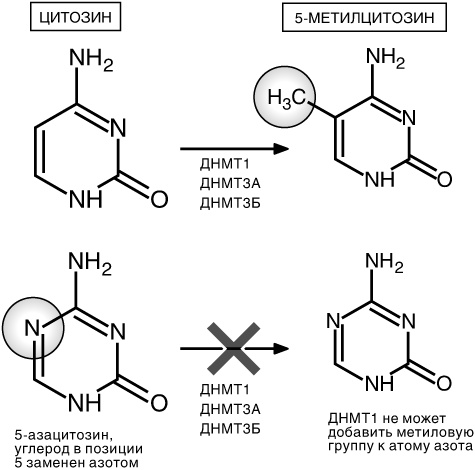
Рис. 11.1. 5-азацитозин может быть включен в ДНК во время копирования ДНК, которое происходит перед делением клетки. 5-азацитозин занимает место основания Ц, но так как в нем находится атом азота в позиции, где должен быть атом углерода, чуждое основание не может быть метилировано ДНМТ1 так, как это показано на рисунке 4.2
Давайте еще раз вернемся к главе 4 и представим себе метилированную область ДНК. При делении клетки она размыкает две цепочки двойной спирали ДНК и копирует каждую из них. Однако ферменты, копирующие ДНК, не могут самостоятельно копировать метилирование ДНК. Как следствие, в каждой новой двойной спирали есть одна метилированная цепочка и одна неметилированная. Метилтрансфераза ДНК под названием ДНМТ1 может узнать ДНК, у которой метилирование ДНК присутствует только на одной цепочке, и может восстановить его на другой цепочке, тем самым восстанавливая изначальную схему метилирования ДНК.
Но если делящиеся клетки обработаны 5-азацитидином, то это аномальное цитидиновое основание добавляется в новую цепочку ДНК при копировании генома. Так как в аномальном основании место атома углерода занимает атом азота, фермент ДНМТ1 не может восстановить отсутствующую метиловую группу. Если это явление повторяется в процессе деления клеток, метилирование ДНК начинает выхолащиваться.
При делении клеток под воздействием 5-азацитидина происходит еще что-то интересное. Теперь известно, что когда ДНМТ1 связывается с областью, в которой ДНК содержит 5-азацитидин вместо обычного цитидина, ДНМТ1 прилипает к нему
[172]. Этот оказавшийся в тупике фермент затем отсылается в другую часть клетки и разрушается. По этой причине общие уровни фермента ДНМТ1 в клетке понижаются
[173]
[174]. Уменьшение количества ДНМТ1 в сочетании с фактом, что 5-азацитидин не может быть метилирован, означает, что объемы метилирования ДНК в клетке продолжают падать. Через некоторое время мы еще вернемся к вопросу о том, почему такое снижение уровня метилирования ДНК оказывается эффективным для борьбы с раком.
Итак, 5-азацитидин является примером того, как противораковый агент неожиданно проявил свои эпигенетические свойства. Как это ни странно, но довольно похожая история произошла и с другим соединением, которое теперь уже стало лицензированным средством лечения рака
[175].
Еще одна счастливая случайность
В 1971 году Шарлотта Френд продемонстрировала, что очень простое химическое соединение под названием ДМСО (полностью его имя звучит как диметилсульфоксид) оказывает неожиданно странное воздействие на раковые клетки мышей, больных лейкемией. Когда эти клетки обрабатывались ДМСО, они становились красными. Происходило это по той причине, что они активировали ген гемоглобина, пигмента, благодаря которому эритроциты имеют красный цвет
[176]. Пораженные лейкемией клетки обычно никогда не активируют этот ген, и механизм этого явления был совершенно неизвестен.
Рональд Бреслоу из Колумбийского университета, а также Пол Маркс и Ричард Рифкинд из Мемориального ракового центра Слоуна-Кеттеринга, были весьма заинтригованы исследованиями Шарлотты Френд. Рональд Бреслоу тут же приступил к разработкам и созданию новых химических соединений, используя в качестве отправной точки строение ДМСО и кое-что добавляя или меняя в нем, как это делается при создании новых конструкций из деталей Лего. Пол Маркс и Ричард Рифкинд начали тестировать эти соединения на различных клеточных моделях. Некоторые из соединений оказывали на клетки иное, нежели ДМСО, воздействие. Они останавливали рост клеток.
После многочисленных экспериментов, дававших важную информацию о новых и все более усложнявшихся соединениях, ученые создали молекулу, получившую название САГК (субероиланилид гидроксамовая кислота). Это химическое соединение оказалось чрезвычайно эффективным препаратом для подавления роста и/или инициирования гибели клеток в популяции раковых клеток
[177]. Однако ученым потребовалось еще целых два года, чтобы определить, что именно САГК делает в клетках. Ключевой момент в изысканиях произошел более чем через 25 лет после появления публикации Шарлотты Френд, когда Виктория Ричон из команды Пола Маркса прочла доклад группы исследователей из Токийского университета, датированный еще 1990 годом.
Японские ученые работали с соединением, которое называется Трихостатин А или ТСА. Как на тот момент уже было известно, ТСА препятствовал размножению клеток. Японские исследователи показали, что применение ТСА меняло пределы, в которых гистоновые белки присоединяли к себе ацетиловую химическую группу в популяции раковых клеток. Гистоновое ацетилирование — это одна из эпигенетических модификаций, с которой мы уже встречались в главе 4. Когда клетки обрабатывались ТСА, уровни гистонового ацетилирования повышались. Происходило это не потому, что это химическое соединение активировало ферменты, которые накладывают ацетиловые группы на гистоны. Причина была в том, что ТСА подавлял ферменты, удалявшие ацетиловые группы с этих хроматиновых белков. Эти белки называются гистондезацетилазами или, для краткости, ГДАЦ
[178].
Виктория Ричон сравнила строение ТСА со строением САГК, которые показаны на рисунке 11.2.
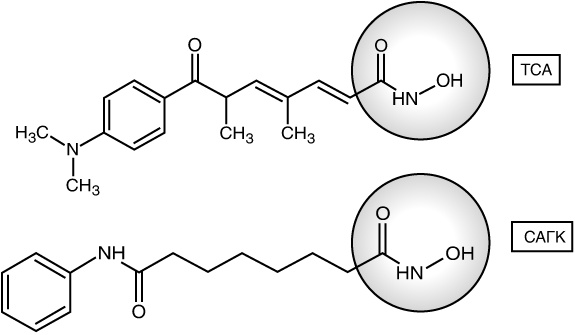
Рис. 11.2. Строения ТСА и САГК. в которых схожие участки заключены в кружки. С — углерод; Н — водород; N — азот; О — кислород.Для упрощения схемы некоторые атомы углерода намеренно не показаны, однако они присутствуют там, где соединение изображено двойной чертой
Не нужно обладать ученой степенью по химии, чтобы заметить, что ТСА и САГК выглядят удивительно похоже, особенно участками, которые находятся справа в цепи. Виктория Ричон предположила, что, подобно ТСА, САГК также подавляет ГДАЦ. В 1998 году она вместе с коллегами опубликовала доклад, в котором подтвердила, что все именно так и обстоит
[179]. САГК не дает ферментам ГДАЦ удалять ацетиловые группы с гистоновых белков, и в результате этого на гистонах оказывается много ацетиловых групп.




