
Онлайн книга «Абсолютный минимум. Как квантовая теория объясняет наш мир»
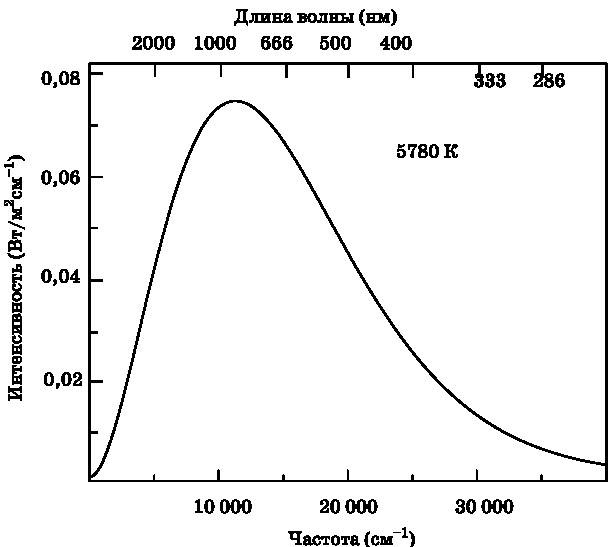
Рис. 9.1. Черноте́льный спектр Солнца, вычисленный по формуле Планка для теплового излучения горячего объекта. Эта кривая хорошо соответствует солнечному спектру, за исключением некоторых тонких деталей. По нижней оси отложены частоты, выраженные числом волн на 1 см (см. текст). По верхней оси отложена длина волны в нанометрах. Зелёный свет — это 500 нм, ярко выраженный голубой — 400 нм, глубокий красный — 666 нм. По вертикальной оси отложена интенсивность излучения (см. текст)
Форма спектра, изображённого на рис. 9.1, почти совпадает с реальным солнечным спектром. Расчётный спектр получен путём подгонки температуры в формуле Планка до наилучшего соответствия экспериментальному спектру. Температура, которая даёт такое соответствие, составляет 5780 K, где K — кельвины. Кельвин — это единица температуры по абсолютной шкале, разработанной Уильямом Томсоном, первым бароном Кельвином (лорд Кельвин, 1724–1907). Шкала Кельвина используется в физике и химии, поскольку нулевая отметка на этой шкале (0 K) имеет чётко определённый физический смысл. При 0 K прекращаются все движения атомов, связанные с кинетической энергией, то есть с теплом, с энергией движения частиц. Чтобы получить температуру в градусах Цельсия (°C), следует из температуры в кельвинах вычесть 273. Таким образом, по шкале Цельсия температура Солнца составляет 5507 °C.
Поразительно, что формула Планка, выведенная с опорой на первую квантовую идею о том, что энергия электронов, «осциллирующих» в металле, не является непрерывной, оказалась применимой к температуре звёзд. Расчётный спектр, изображённый на рис. 9.1, является непрерывным, поскольку горячий объект порождает непрерывное распределение цветов (энергии квантов света). Хотя экспериментальные данные в целом соответствуют кривой на рис. 9.1, на них также совершенно отчётливо проявляются детали, которые отсутствуют на черноте́льном спектре Солнца. На рис. 9.2 изображён солнечный спектр с тёмными линиями, отражающими нехватку света некоторых частот. Спектр, изображённый на рис. 9.1, соответствует излучению, испускаемому Солнцем. Тёмные линии — это узкие диапазоны длин волн, которые не доходят до Земли. Они называются линиями, или полосами, поглощения. Те же самые линии совершенно отчётливо видны в спектрах света, приходящего от других звёзд.
Длины волн, соответствующие тёмным линиям в солнечном спектре, можно наблюдать как отдельные цвета дуговой лампы, заполненной водородом. Водородная дуговая, или газоразрядная, лампа представляет собой заполненный водородом герметичный стеклянный цилиндр с электродами на концах. Когда достаточно высокий положительный электрический потенциал подаётся на один электрод, а отрицательный — на другой, в лампе возникает электрическая дуга, подобная маленькой непрерывно бьющей молнии. Цвета, или длины волн, в диапазоне видимого света, испускаемые лампой, соответствуют длинам волн тёмных линий спектра на рис. 9.2.

Рис. 9.2. Видимая часть солнечного спектра. Непрерывная последовательность цветов — это черноте́льный спектр. Тёмные линии, или полосы, — это цвета, соответствующие длинам волн, которые не доходят до Земли, так что они выглядят отсутствующими цветами в солнечном спектре. Длины волн этих линий отложены на шкале вдоль спектра в нанометрах (1 нм = 10−9 м)
Первая попытка объяснить линейчатый спектр водорода в видимом диапазоне была предпринята в 1885 году школьным учителем и математиком Иоганном Бальмером (1825–1898). Бальмер заметил, что частоты f этих линий в видимой части спектра можно описать формулой
f~(1/22)−(1/n2).
Символ ~ означает пропорциональность, то есть указывает на наличие постоянного множителя, о котором говорится ниже. В этом уравнении n — целое число больше 2, то есть 3, 4, 5 и т. д.
Эти линии в видимой части спектра называются бальмеровской серией. Позднее были открыты линии в ультрафиолетовой и инфракрасной частях спектра. Их назвали сериями Лаймана и Пашена соответственно в честь их первооткрывателей — американского физика и спектроскописта Теодора Лаймана (1874–1954) и немецкого физика Луиса Карла Генриха Фридриха Пашена (1865–1947). В 1888 году шведский физик и спектроскопист Йоханнес Ридберг (1854–1919) опубликовал формулу, которая описывала все спектральные линии, видимые в излучении водородной дуговой лампы и в спектрах поглощения солнечного и звёздного света. Формула Ридберга для частоты спектральных линий водорода имеет вид
f=RH∙[(1/n12)−(1/n22)],
где n1 — целые числа, начиная с 1, а n2 — другие целые числа, которые должны быть больше n1. Значение n1=1 даёт лаймановскую серию, n1=2 — бальмеровскую, n1=3 — серию Пашена.
Константа RH называется постоянной Ридберга для атома водорода. Её значение составляет RH=109677,6 см−1 и выражено числом волн (см−1). При использовании этого значения в формуле Ридберга частоты спектральных линий, определяемые целыми числами n1 и n2, выражаются волновыми числами. Для перевода результата в герцы надо умножить полученное значение на скорость света, то есть на 3∙1010 см/сек. Чтобы найти длину волны спектральной линии, надо взять величину, обратную частоте, выраженной числом волн, то есть разделить единицу на частоту, выраженную числом волн. Например, если n1=2, а n2=3, то
f=RH∙[(1/22)−(1/32)] = RH∙[(1/4)−(1/9)] = 1,52∙104 см−1
представляет собой частоту, выраженную числом волн. Обратная величина для этого числа составляет 6,56∙10−5 см = 656∙10−9 м = = 656 нм. Таким образом, длина волны составляет 656 нм — это красная линия в серии Бальмера, изображённой на рис. 9.2.
При обсуждении рис. 8.7 уже говорилось о дискретности оптических переходов между квантовыми энергетическими уровнями для частицы в ящике. На рис. 8.7 показаны переходы между состояниями частицы в ящике, при которых n=1 превращается в n=2 и n=1 превращается в n=3. В связи с этим не должен стать большим сюрпризом тот факт, что оптические переходы в атоме водорода могут соответствовать дискретному набору частот, которые зависят от целых чисел. Однако в 1888 году, когда была получена формула Ридберга, оставалось ещё 12 лет до появления идеи квантования энергетических уровней, с помощью которой Планк объяснил черноте́льное излучение, и 37 лет до того, как в 1925 году сформировалась полноценная квантовая теория. Различные серии спектральных линий, энергии которых связаны посредством целых чисел по формуле Ридберга, можно понять как оптические переходы между дискретными энергетическими уровнями, связанные с атомом водорода.
