Когда два электрона находятся на одной орбитали, их спины называют спаренными. Электрон на орбитали (энергетическом уровне) изображается стрелкой (см. рис. 11.2). Спиновое квантовое число s=+½ изображается стрелкой, направленной вверх. Спиновое квантовое число s=−½ изображается стрелкой, направленной вниз. На любой отдельно взятой орбитали может быть не более одной стрелки вверх и одной стрелки вниз.
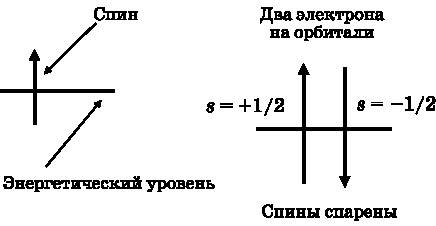
Рис. 11.2.Слева: электрон изображён стрелкой на орбитали. Справа: два электрона на одной орбитали. Чтобы удовлетворять принципу запрета Паули, их квантовые числа s должны иметь значения +½ и −½, представленные стрелками, направленными вверх и вниз. О таких спинах говорят, что они спаренные
Правило 2: сначала наименьшая энергия, но без нарушения принципа Паули
Правило 2 состоит в том, что орбитали заполняются электронами в порядке увеличения энергии. Электроны сначала заселяют самый нижний доступный энергетический уровень, но при этом не должен нарушаться принцип Паули. Таким образом, в атоме гелия (He) электроны могут занять энергетический уровень 1s — один со спином «вверх» (s=+½) и один со спином «вниз» (s=−½). Три квантовых числа совпадают, но значения s различаются, так что принцип Паули не нарушается. Li — следующий по величине атом, с тремя электронами. Третий электрон не может разместиться на уровне 1s, поскольку все четыре его квантовых числа (n, l, m и s) совпадали бы с одним из двух других электронов, и, значит, третий электрон должен занять более высокий уровень — 2s-орбиталь. Это самый низкий из доступных уровней для третьего электрона. Поэтому правило 2 предписывает ему заселиться именно сюда.
Правило 3 (правило Хунда): спины не спариваются, если это возможно без нарушения правил 1 и 2
Правило 3 называется правилом Хунда. Оно утверждает, что, заполняя орбитали с одинаковой энергией, электроны остаются по возможности неспаренными. На рис. 11.3 правило Хунда проиллюстрировано на примере 2p-орбиталей. Первый электрон, обозначенный на рисунке цифрой 1, занимает 2px-орбиталь. Этот выбор произволен, поскольку все три 2p-орбитали имеют одинаковую энергию. Согласно правилу Хунда, второй электрон займёт одну из двух других 2p-орбиталей, имеющих одинаковую энергию, так чтобы спины не спаривались. В нашем примере он попадает на 2py-орбиталь. Третий электрон должен заселиться на 2pz-орбиталь — это единственный способ соблюсти правило Хунда, а также правила 1 и 2. Наконец, четвёртый электрон спаривается с одним из остальных электронов. Как показано на рисунке, он занимает 2px-орбиталь. Его спин должен быть направлен вниз, чтобы соблюдался принцип Паули, правило 1.
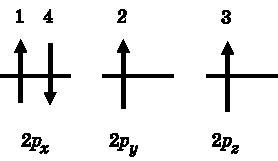
Рис. 11.3.
Иллюстрация правила Хунда. При заселении 2p-орбиталей электрон 1 занимает 2p
x
-орбиталь, электрон 2 — 2p
y
, электрон 3 — 2p
z
. Все они имеют спин, направленный вверх. Электрон 4 обязан будет иметь спин, направленный вниз, чтобы спариться во избежание нарушения принципа Паули
Правило Хунда возникает потому, что оно даёт электронные конфигурации с наименьшей возможной энергией. При заселении двух электронов на две разные 2p-орбитали они размещаются в среднем дальше друг от друга, чем при заселении на одну и ту же орбиталь. Энергия уменьшается, поскольку удаление электронов друг от друга приводит к ослаблению их взаимного отталкивания. Таким образом, правило Хунда, по сути, требует помещать электроны по возможности на разные орбитали. Хотя факт уменьшения энергии при сохранении электронов неспаренными весьма важен, величина, на которую снижается энергия, незначительна. Поэтому лучше спарить электрон 4 на 2px-орбитали, чем разместить его неспаренным на более высокоэнергетической 3s-орбитали.
Периодическая таблица элементов
Итак, мы изложили правила расселения электронов по энергетическим уровням, изображённым на рис. 11.1. Теперь эти правила будут использоваться для понимания многочисленных свойств атомов и Периодической таблицы элементов. Кроме того, точно такие же правила будут очень важны при обсуждении молекул в последующих главах. Однако сначала нам необходимо познакомиться с Периодической таблицей (рис. 11.4).
В Периодической таблице каждому элементу соответствует клетка. В этой клетке записан символ элемента, а также его атомный номер. Атомный номер — это число положительно заряженных протонов в ядре элемента. Для нейтрального атома (в отличие от положительно или отрицательно заряженного иона) атомный номер — это также число отрицательно заряженных электронов. О строении Периодической таблицы будет во всех подробностях рассказано далее. В её левом верхнем углу расположен водород (символ H, атомный номер 1). В правом верхнем углу находится гелий (символ He, атомный номер 2). Под водородом располагается литий (символ Li, атомный номер 3).
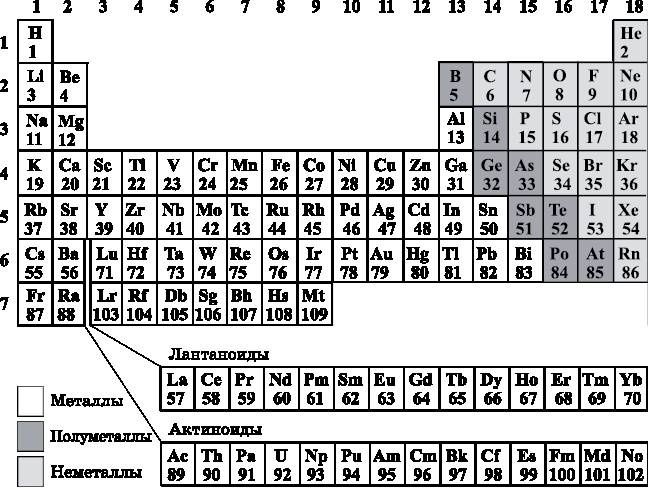
Рис. 11.4.
Периодическая таблица элементов
Многие символы являются просто аббревиатурами названий. Но это не всегда так. Например, свинцу (элемент 82) соответствует буквенный символ Pb, производный от латинского названия свинца plumbum. Поскольку по символам не всегда легко понять, как называется элемент, в табл. 11.1 приведены названия, символы и атомные номера элементов. Названия элементов в таблице упорядочены по алфавиту. Если по буквенному символу элемента вы не можете определить его название, просматривайте сверху вниз колонку символов, пока не найдёте нужный.
Таблица
11.1. Список элементов (в алфавитном порядке названий)
Элемент, Символ, Атомный №
Азот N 7
Актиний Ac 89
Алюминий Al 13
Америций Am 95
Аргон Ar 18
Астат At 85
Барий Ba 56
Бериллий Be 4
Берклий Bk 97
Бор B 5
Борий Bh 107
Бром Br 35

