
Онлайн книга «Абсолютный минимум. Как квантовая теория объясняет наш мир»
В отличие от ионного типа связи в кристаллах, которые скрепляются электростатическим взаимодействием, ковалентную связь классическая механика объяснить не может. В главе 11 мы узнали, что атом водорода имеет тенденцию образовывать ковалентную связь с другим атомом для совместного использования одного электрона. Это совместное использование наделяет атом H замкнутой конфигурацией электронной оболочки гелия. Но что представляет собой ковалентная связь? Почему атомы водорода совместно используют электроны, образуя молекулу H2, а атомы гелия не используют электроны совместно для образования молекулы He2? Сначала мы рассмотрим природу ковалентной связи на примере простейшей молекулы H2, а затем, в последующих главах, расширим обсуждение ковалентной связи на более сложные молекулы. К концу этой главы станет ясно, почему существует молекула H2, но нет молекулы He2.
Два атома водорода, назовём их a и b, не взаимодействуют, когда они значительно удалены друг от друга. Если расстояние между ними велико, то электрон атома водорода a будет чувствовать лишь кулоновское притяжение протона атома a. Электрон атома водорода b будет взаимодействовать только с протоном атома b. Теперь мы знаем, как описывать разделённые атомы водорода. Пусть оба они находятся в своём низшем энергетическом состоянии 1s. Электрон описывается волновой функцией 1s, которая представляет собой атомную орбиталь. Она определяет амплитуду вероятности обнаружить электрон в данной области пространства. Квадрат волновой функции показывает вероятность обнаружить электрон. Состояние 1s для атома водорода достаточно подробно обсуждалось в главе 10 (см. рис. 10.2–10.4).
Теперь рассмотрим, что случится, когда мы станем постепенно приближать друг к другу атомы водорода. Когда они сблизятся, но не слишком сильно, то начнут чувствовать друг друга. Ниже мы оценим это расстояние количественно. Электрон в атоме водорода a начнёт чувствовать притяжения протона атома b и отталкивание электрона атома b. Точно так же электрон атома водорода b притягивается протоном атома a и отталкивается электроном того же атома. Кроме того, положительно заряженные протоны атомов a и b отталкиваются друг от друга, поскольку имеют одинаковый заряд.
Можно решить уравнение Шрёдингера для данной задачи. Хотя это нельзя сделать строго, точность может быть очень высокой. Что даёт нам это решение уравнение Шрёдингера? Оно даёт энергетические уровни системы и её волновые функции. Когда мы решали задачу о частице в ящике, мы получили волновую функцию одиночной частицы в гипотетическом одномерном ящике с бесконечно высокими стенками. В случае уравнения Шрёдингера для атома водорода или других атомов мы получаем энергетические уровни и атомные волновые функции — атомные орбитали. Решая молекулярную задачу, мы получаем квантованные значения энергии для молекулярных энергетических уровней и молекулярные волновые функции. Последние обычно называют молекулярными орбиталями. Таким образом, для атомов мы получаем атомные орбитали, описывающие распределение вероятности обнаружения электрона вокруг атомного ядра. Это волна амплитуды вероятности. Молекулярная орбиталь описывает распределение вероятности обнаружения электронов в молекуле вокруг ядер тех атомов, из которых состоит молекула. У молекулы водорода имеется два электрона и два атомных ядра — два протона.
Очень хороший способ понять, как связываются атомы водорода, когда они сближаются и образуют молекулу водорода, основывается на концепции, известной как приближение Борна-Оппенгеймера. Как говорилось в главе 5, Борн получил Нобелевскую премию по физике в 1954 году за свою вероятностную интерпретацию волновой функции. Оппенгеймер внёс большой вклад в физику. Наибольшую известность он получил как физик, руководивший во время Второй мировой войны Манхэттенским проектом, в рамках которого разрабатывалась и испытывалась первая атомная бомба. В приближение Борна-Оппенгеймера требуется поместить два ядра атомов водорода (два протона) на фиксированном расстоянии друг от друга. Начнём с расстояния, которое вы сочтёте достаточно большим, чтобы атомы водорода не чувствовали друг друга. Выполним квантовомеханический расчёт энергии. Если атомы находятся далеко друг от друга, то эта энергия будет равна просто удвоенной энергии атома водорода в 1s-состоянии, поскольку имеется всего два атома водорода. Теперь немного уменьшим расстояние и повторим вычисления, а потом ещё уменьшим расстояние и вновь выполним вычисления. Когда расстояние между ядрами в нашем расчёте станет достаточно малым, атомы почувствуют друг друга. Если должна образоваться химическая связь, то есть если два атома водорода собираются объединиться в молекулу водорода, то энергия должна убывать. Для образования связи энергия молекулы должна быть меньше, чем энергия атомов, когда они разнесены далеко друг от друга.
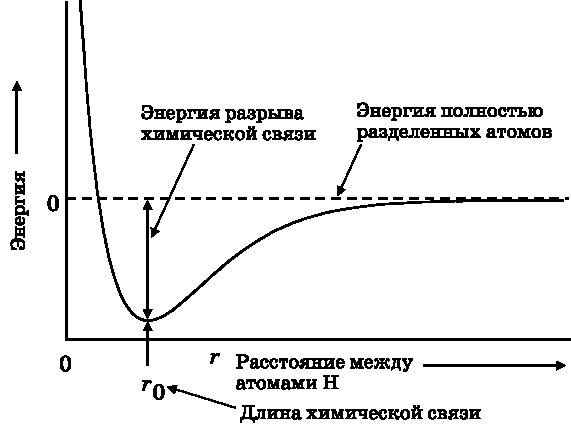
Рис. 12.1. График зависимости энергии двух атомов водорода от расстояния между ними. Когда два атома H находятся очень далеко друг от друга, энергия системы равна сумме энергий 1s-орбиталей двух атомов H. Эта величина принимается за нулевое значение энергии, отмеченное штриховой линией. При сближении атомов энергия убывает, пока не достигает минимума. Если атомы сближаются ещё сильнее, энергия быстро возрастает
На рис. 12.1 представлен график изменения энергии двух атомов водорода в процессе их сближения друг с другом. Как уже отмечалось, когда два атома водорода находятся очень далеко друг от друга, они не взаимодействуют. Каждый из них имеет энергию, соответствующую 1s-орбитали атома водорода. Будем считать это нулевым уровнем энергии. Сам по себе атом водорода имеет отрицательную энергию, как это объяснялось в главе 10. Эта энергия соответствует энергии связи электрона с протоном (ядром). Сейчас нас интересует изменение энергии, когда два атома водорода вступают во взаимодействие. Мы хотим найти энергию, ассоциированную с химической связью, поэтому нулевая энергия — это та, при которой химическая связь отсутствует. На рис. 12.1 нулевая энергия обозначена штриховой линией. Это энергия, соответствующая состоянию, когда атомы полностью разделены. По горизонтальной оси отложено расстояние r между двумя атомами H. По мере сближения атомов H энергия начинает убывать, причём всё быстрее и быстрее. Она достигает минимума при расстоянии между атомами r0 (см. рис. 12.1). Если атомы сближаются ещё сильнее, энергия очень быстро возрастает, то есть когда атомы находятся слишком близко, они отталкиваются друг от друга. Поскольку при сближении двух атомов энергия убывает, между ними образуется химическая связь.
