В табл. 12.1 содержится количественная информация об этих четырёх молекулах. В ней приводятся число связывающих электронов, число разрыхляющих электронов и итоговый результат, равный разности числа связывающих электронов и числа разрыхляющих. В таблице также приводится порядок связи. Последние две колонки особенно интересны.
Таблица 12.1.Свойства молекулярного иона водорода H2+, молекулы водорода H2, молекулярного иона гелия He2+ и молекулы He2
Связ. электроны, Разр. электроны, Разность, Порядок связи, Длина связи, Энергия связи
H2: 2; 0; 2; 1; 0,74Å; 7,2∙10−19Дж
H2+: 1; 0; 1; ½; 1,06Å; 4,2∙10−19Дж
He2+: 2; 1; 1; ½; 1,08Å; 5,4∙10−19Дж
He2: 2; 2; 0; 0; Нет; Нет
Данные, приведённые в табл. 12.1, — это результаты экспериментальных измерений. Прежде всего, остановимся на длине химической связи. Она выражена в ангстремах (1 Å = 10−10 м). Молекулярный ион H2+ имеет связь порядка ½ и длину химической связи 1,06 Å. Для сравнения отметим, что молекула H2 имеет полноценную связь порядка 1 и длину химической связи 0,74 Å. Дополнительный электрон на связывающей МО в молекуле H2 удерживает атомы крепче и потому теснее. Молекулярный ион He2+ имеет связь порядка ½ и длину химической связи 1,08 Å, которая лишь незначительно больше, чем у молекулярного иона H2+. Конечно, He2 — это не молекула и поэтому не имеет химической связи. В последнем столбце приведена энергия связи в единицах 10−19 Дж. Интересна относительная сила связи. Молекула H2 со связью порядка 1 имеет существенно бо́льшую энергию связи, чем два молекулярных иона, в которых порядок связи составляет ½. Так простые диаграммы МО позволяют узнать, будет ли существовать связь, и дают информацию о том, насколько сильной она окажется.
В этой главе мы воспользовались представлениями о молекулярных орбиталях для рассмотрения простейших молекул. Обсуждение касалось только атомов, содержащих 1s-электроны. Все остальные атомы и молекулы содержат больше электронов и больше орбиталей. В следующей главе представленные здесь идеи будут использоваться для анализа двухатомных молекул, включающих более крупные атомы, такие как молекула кислорода O2 и молекула азота N2. Эти две молекулы являются основными составляющими воздуха, которым мы дышим.
13. Что удерживает атомы вместе: двухатомные молекулы
Молекула водорода является двухатомной, то есть состоит лишь из двух атомов. В процессе изучения водорода мы обнаружили, что атомы могут объединять свои атомные орбитали, образуя молекулярные орбитали. Нам предстоит расширить обсуждение молекулярных орбиталей, с тем чтобы понять, как из атомов образуются более сложные молекулы. Начнём мы с рассмотрения других двухатомных молекул на примере N2, O2, F2 и HF. Молекулы N2, O2 и F2 (азот, кислород и фтор) называются гомонуклеарными, поскольку состоят из одинаковых атомов. Молекула HF (фтороводород) — гетеронуклеарная, поскольку два её атома различны. Анализ гомонуклеарных двухатомных молекул выведет нас за рамки того, что мы узнали о молекуле водорода, которая является частным случаем. Изучение природы молекулярных орбиталей в гетеронуклеарных двухатомных молекулах — это важный шаг вперёд к пониманию многоатомных молекул, из которых состоит большинство окружающих нас молекулярных веществ — от спирта до жиров.
Молекула водорода — единственная нейтральная молекула, в которой для образования химических связей служат только электроны, находящиеся на 1s-обитателях. Электроны, используемые атомами для связывания между собой, называются валентными. В молекулах N2, O2, F2 и HF в образование связей вовлечены орбитали 2s и 2p. 2s- и 2p-электроны являются валентными электронами. Атомы N, O, и F расположены во второй строке Периодической таблицы. У атомов из третьей строки Периодической таблицы, таких как P, S и Cl (фосфор, сера и хлор), связывание обеспечивается валентными 3s- и 3p-электронами. Атомы из третьей и последующих строк Периодической таблицы могут также использовать для образования химических связей d-электроны. Здесь мы сконцентрируемся на очень важных элементах второй строки, но идеи, с которыми мы познакомимся, обладают значительной общностью и охватывают природу химических связей более тяжёлых элементов.
Сигма-связи (σ) и пи-связи (π)
Как показано на рис. 12.2, когда два атома водорода образуют молекулу H2, две 1s-орбитали водорода объединяются и формируют связывающую молекулярную орбиталь. Вдоль оси, соединяющей ядра, при этом имеется определённая электронная плотность. Связывающая и разрыхляющая молекулярные σ-орбитали (сигма-орбитали) имеют ненулевую электронную плотность вдоль линии, соединяющей ядра. Мы говорим, что в молекуле H2 σ-связь образована с использованием связывающей молекулярной σ-орбитали. s-орбитали всегда образуют σ-связи. Не существует способа объединить две s-орбитали и не получить никакой электронной плотности вдоль линии, соединяющей ядра. Однако для p-орбиталей это не так.
С учётом формы p-орбиталей их пары могут объединяться двумя способами, представленными на рис. 13.1. Орбитали на рисунке изображены очень схематично. В действительности это волны амплитуды вероятности, задающие диффузное распределение вероятности обнаружить электрон в том или ином месте относительно ядра. Приведённые здесь контуры отражают лишь общую форму p-орбиталей. Это лучше проиллюстрировано на рис. 10.7. Напомним, что у p-орбиталей есть узловая плоскость, располагающаяся между двумя лепестками. В узловой плоскости вероятность обнаружить электрон равна нулю. Для pz-орбитали узловой является плоскость xy (см. рис. 10.7). Вероятность обнаружить электрон в некоторой области пространства часто называют электронной плотностью. Высокая плотность означает высокую вероятность обнаружения электрона.
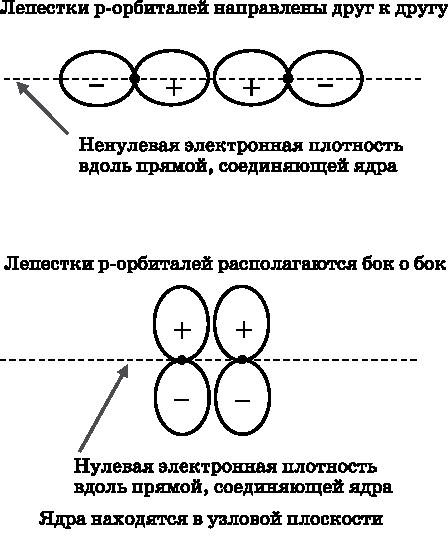
Рис. 13.1.
Пара сблизившихся между собой p-орбиталей. Вверху: орбитали сближаются концами; вдоль линии, соединяющей ядра, имеется ненулевая электронная плотность. Внизу: орбитали сближаются боками; вдоль линии, соединяющей ядра, электронная плотность равна нулю
В верхней части рис. 13.1 изображены две орбитали, сближающиеся друг с другом концами. Их лепестки направлены друг к другу. Ядра изображены жирными точками. Штриховая прямая соединяет ядра. Очевидно, что вдоль этой прямой, соединяющей ядра, имеется ненулевая электронная плотность. В нижней части рисунка изображены 2p-орбитали, сближающиеся друг с другом боками. Узловая плоскость перпендикулярна плоскости страницы. Ядра находятся в этой узловой плоскости. Вдоль прямой, соединяющей ядра, электронная плотность равна нулю. Лепестки орбиталей имеют знак: один лепесток положительный, а другой отрицательный. На обеих схемах (см. рис. 13.1) друг с другом сближаются положительные лепестки.

