Сигма-орбитали молекул
Если атомные орбитали сближаются достаточно тесно, они могут образовывать связывающие и разрыхляющие молекулярные орбитали. Сначала мы рассмотрим образуемые атомными s- и p-орбиталями связывающие и разрыхляющие молекулярные σ-орбитали. У таких орбиталей имеется отличная от нуля электронная плотность вдоль линии, соединяющей ядра. Как уже говорилось, s-орбитали могут образовывать только σ-орбитали, поскольку имеют сферическую форму. p-орбитали тоже могут образовывать σ-МО.
На рис. 13.2 представлены связывающие и разрыхляющие σ-МО, образованные как s-орбиталями, так и p-орбиталями. В верхней части рисунка изображены два возможных способа объединения s-орбиталей. s-орбитали — это волны, и с ними может быть связан либо знак «плюс», либо знак «минус». Вверху обе s-орбитали имеют знак «плюс». Когда они объединяются, волны этих s-орбиталей интерферируют конструктивно и порождают σ-связывающую МО. Ниже на рисунке одна s-орбиталь имеет знак «плюс», а другая — знак «минус». Когда они объединяются, то интерферируют деструктивно и образуют разрыхляющую МО. Связывающая МО концентрирует электронную плотность между ядрами, тогда как разрыхляющая МО выталкивает электронную плотность вовне, уменьшая несущую отрицательный заряд электронную плотность между ядрами. Положительно заряженные ядра отталкиваются сильнее, что и делает эту конфигурацию разрыхляющей.
В нижней части рис. 13.2 показаны результаты объединения двух орбиталей с получением молекулярных σ-орбиталей. σ-p-связывающие МО образуются в результате перекрытия положительных лепестков одной p-орбитали с положительными лепестками другой p-орбитали. Возникает конструктивная интерференция между положительными лепестками, создающая высокую электронную плотность между атомными ядрами. Имеются две узловые плоскости, перпендикулярные странице. Эти две узловые плоскости наследуются от двух атомных p-орбиталей. Напротив, в самом низу рисунка показано, как положительные лепестки одной p-орбитали перекрываются с отрицательными лепестками другой p-орбитали.
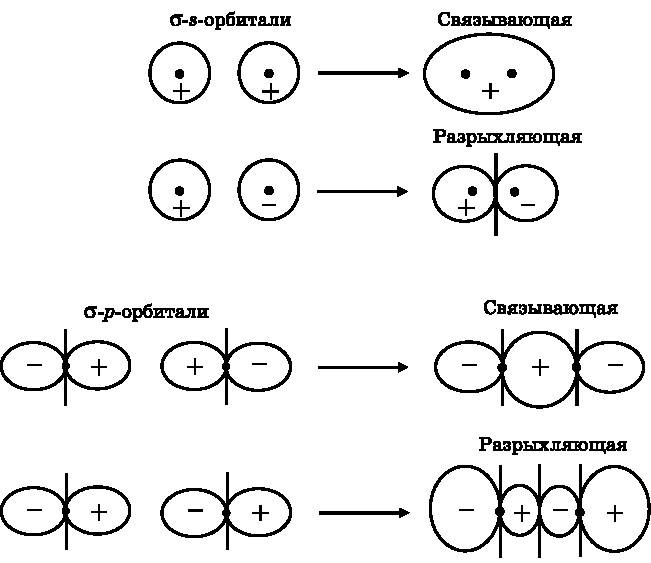
Рис. 13.2.Вверху: пара s-орбиталей перекрывается двумя разными способами, давая σ-связывающую (конструктивная интерференция) и σ-разрыхляющую (деструктивная интерференция) молекулярные орбитали. Внизу: пара p-орбиталей перекрывается двумя способами, давая σ-связывающую (конструктивная интерференция) и σ-разрыхляющую (деструктивная интерференция) молекулярные орбитали. Во всех случаях вдоль линии, соединяющей ядра, имеется ненулевая электронная плотность
В результате деструктивной интерференции образуется разрыхляющая МО. Электронная плотность выталкивается наружу и значительно уменьшается между двумя ядрами. В дополнение к двум узловым плоскостям, унаследованным от атомных орбиталей, появляется третья узловая плоскость, которая возникает благодаря полной деструктивной интерференции между положительным и отрицательным лепестками двух атомных p-орбиталей. У всех этих связывающих и разрыхляющих МО, образованных из атомных p-орбиталей, на линии, соединяющей ядра, электронная плотность отлична от нуля. Следовательно, это σ-МО.
Молекулярные пи-орбитали
s-орбитали могут формировать только σ-МО, но p-орбитали могут образовывать как σ-МО, так и другой тип молекулярных орбиталей, обозначаемых π (греческая буква «пи»). Когда атомные орбитали сближаются концами, они образуют σ-МО. Когда они сближаются боками, они образует π-МО (рис. 13.3).
В верхней части рисунка две p-орбитали образуют связывающую молекулярную орбиталь. Положительный лепесток одной атомной орбитали перекрывается с положительным лепестком другой, и аналогично для отрицательных лепестков. Как видно из рисунка, в области между двумя ядрами возникает значительная электронная плотность. Однако вдоль прямой, соединяющей ядра, электронная плотность равна нулю. Имеется узловая плоскость, перпендикулярная плоскости страницы, поскольку у каждой из атомных орбиталей есть такая узловая плоскость. Эта узловая плоскость проходит через ядра. Несмотря на наличие узловой плоскости, электронная плотность непосредственно над и под линией, соединяющей ядра, уменьшает отталкивание положительных ядерных зарядов. Энергия становится ниже, чем у отдельных атомов, что приводит к образованию π-связывающей МО.
В нижней части рис. 13.3 показана π-связывающая МО. Две атомные p-орбитали сближаются боками, но положительный лепесток одной орбитали перекрывается с отрицательным лепестком другой, и наоборот. Результатом становится деструктивная интерференция между лепестками, приводящая к появлению π-разрыхляющей МО. Разрыхляющая МО имеет значительно меньшую электронную плотность между ядрами. Вследствие этого энергия становится выше, чем у отдельных атомов, и поэтому такая конфигурация атомных орбиталей порождает разрыхляющую МО.
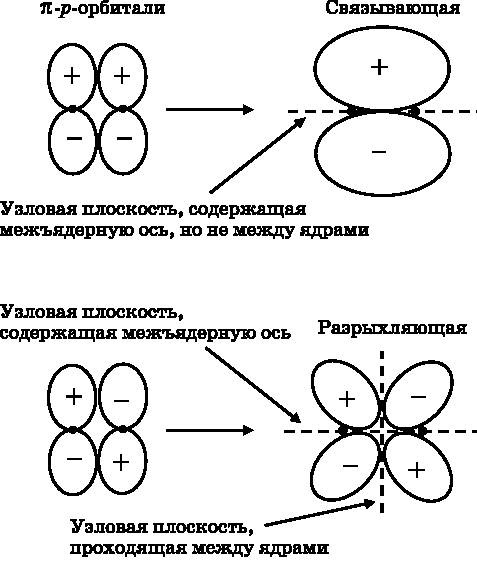
Рис. 13.3.Вверху: пара p-орбиталей перекрывается, сближаясь боками, что даёт связывающую π-орбиталь (конструктивная интерференция); вдоль линии, соединяющей ядра, электронная плотность равна нулю. Внизу: пара p-орбиталей перекрывается, сближаясь боками, с образованием разрыхляющей π-орбитали (деструктивная интерференция). Обратите внимание на знаки лепестков атомных p-орбиталей. У разрыхляющей МО имеется узловая плоскость, проходящая между ядрами
Связи в двухатомных молекулах: молекула фтора
Теперь мы готовы к обсуждению связей в двухатомных молекулах с атомами, отличными от водорода. Начнём с двухатомной молекулы фтора F2. Будем использовать тот же подход, что применялся для H2, но теперь имеется больше орбиталей, и в дело вовлечено больше электронов. Представим, что мы сближаем два атома F и останавливаемся в точке с наименьшей энергией. Это расстояние, на котором два атома F удерживаются, когда они связаны (в предположении, что они образуют связь), как на рис. 12.5. Можно нарисовать диаграмму энергетических уровней, как на рис. 12.6. Необходимо определить ось, вдоль которой будут сближаться атомы, поскольку у них имеются pz-, px- и py-орбитали. Необходимо учитывать, сближаются p-орбитали концами или боками. Когда два атома (обозначим их a и b) сближаются вдоль оси z (рис. 13.4), pz-орбитали встречаются концами, а px- и py-орбитали — боками. Поэтому атомные pz-орбитали будут образовывать σ-МО, а px- и py-орбитали — π-МО.

