Материал этой и следующей глав необходим для понимания связей в многоатомных молекулах. В следующей главе нам понадобится расширить изложенные здесь идеи на молекулы, содержащие более двух атомов. Многоатомные молекулы могут иметь разные формы, и для их понимания мы введём новое понятие гибридных атомных орбиталей. В последующих главах материал глав 13 и 14 будет использоваться для анализа широкого круга вопросов, например для выяснения, что такое ненасыщенные жиры и чем они отличаются от других жиров.
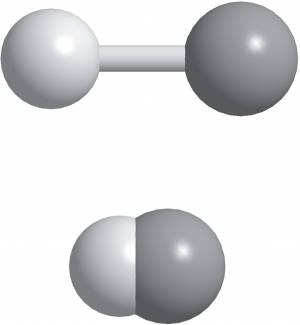
Рис. 13.12.
Различные представления молекулы HF. H — светлый тон; F — тёмный. Вверху: шаростержневая модель показывает, как связаны атомы, а также их относительные размеры. Внизу: объёмная модель, которая более реалистична
14. Более крупные молекулы: формы многоатомных молекул
Окружающий нас мир состоит из многоатомных молекул. Так называют молекулы, состоящие из более чем двух атомов. По размерам они варьируются от трёхатомных молекул, таких как углекислота (CO2), которая является важнейшим парниковым газом, до молекул, состоящих из тысяч атомов, таких как крупные протеины, ответственные за большинство биологических функций. Как говорилось в главе 12, двухатомные молекулы могут иметь только одну форму — линейную. Более крупные молекулы, однако, могут быть очень сложными по форме и строению. Например, насыщенные жиры, ненасыщенные жиры и полиненасыщенные жиры различаются формой и строением, которые определяются природой химических связей. Конкретная большая молекула может иметь более одной формы. Транс-жиры, которые сегодня частично удаляются из пищи (см. главу 16), отличаются лишь формой от молекул, состоящих из той же последовательности атомов, но не являющихся транс-жирами. Центральный вопрос при изучении молекул состоит в том, каким образом они приобретают форму и как различные возможные формы молекул образуются из одних и тех же атомов, соединённых между собой одним и тем же способом.
Прежде чем двигаться дальше, надо подчеркнуть, что ковалентная связь, ответственная за удержание атомов в молекулах, представляет собой сугубо квантовомеханическое явление. Объяснить природу химических связей и строение молекул до появления квантовой теории было невозможно. Лайнус Полинг (1901–1994) получил Нобелевскую премию по химии в 1954 году
«за результаты исследования природы химической связи и их применение к объяснению строения сложных молекул».
Достойно упоминания, что Лайнус Полинг был одним из немногих людей, заслуживших две Нобелевские премии. В 1962 году он получил Нобелевскую премию мира.
Формы молекул: тетраэдрический метан
Для изучения форм молекул и того, каким образом они определяются химическими связями, нам необходимо познакомиться с некоторыми новыми представлениями об атомных орбиталях. Чтобы коснуться этих важных вопросов, мы воспользуемся метаном в качестве примера относительно простой многоатомной молекулы.
Метан (природный газ) имеет формулу CH4. Теперь обратимся вновь к Периодической таблице и положению в ней углерода (см. рис. 11.4). Заметьте, что углероду необходимо создать четыре ковалентные связи за счёт совместно используемых пар электронов, чтобы достичь такой замкнутой конфигурации оболочки, как у неона. В метане углерод создаёт четыре связи с четырьмя атомами водорода. Схему взаимосвязи атомов можно изобразить в виде простой диаграммы, представленной в левой части рис. 14.1. Каждая линия соответствует ковалентной связи, образованной электронной парой. Однако эта диаграмма мало что говорит нам о форме молекулы метана, которая не является плоской. В правой части рисунка изображена шаростержневая модель, которая отражает трёхмерную форму молекулы метана. (Шаростержневые и объёмные модели молекул обсуждались в конце главы 13.)
Метан представляет собой правильный тетраэдр. Представьте, что у вас есть модель, изображённая справа на рис. 14.1, и вы склеиваете куски бумаги в форме правильных треугольников, как раз закрывающих три атома водорода. Можно склеить между собой четыре таких треугольника — три по бокам и один в основании. Эти четыре треугольника образуют правильную треугольную пирамиду с атомами водорода в вершинах и углеродом в центре. Углы, образуемые прямыми, идущими от двух атомов водорода к углероду, составляют ровно 109,5°
. Это верно для всех четырёх таких углов. Они равны между собой. В идеальной тетраэдрической молекуле этот угол составляет 109,5°.
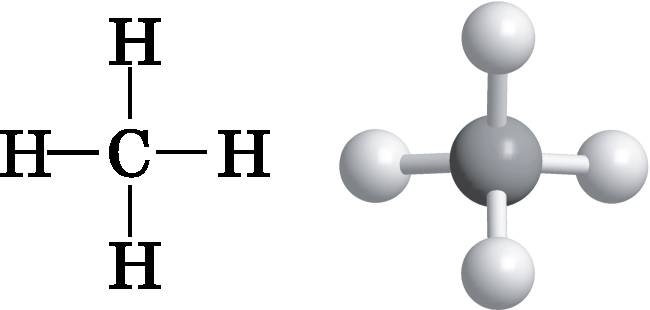
Рис. 14.1.
Слева: диаграмма, показывающая связи в молекуле метана, но не отражающая её трёхмерную форму. Справа: трёхмерная шаростержневая модель, которая демонстрирует тетраэдрическую форму его молекулы
Форма определяется минимизацией отталкивания между связями
Почему метан имеет тетраэдрическую форму? В главе 13 мы узнали, что связывающие молекулярные орбитали концентрируют электронную плотность между атомными ядрами. Концентрация электронной плотности между ядрами показана на рис. 13.2 и 13.3 для σ- и π-связей. В главе 13 обсуждались двухатомные молекулы, в которых связываются только два атома. Мы не беспокоились о том, как будет организовываться множество атомов с определённым набором связей между ними. Хотя для детального расчёта форм молекул необходима квантовая теория, фундаментальные причины, по которым та или иная молекула имеет определённую форму, например тетраэдрическую, очень просты. В многоатомных молекулах электроны, совместно используемые двумя атомами для образования связи, концентрируют электронную плотность между ядрами точно так же, как это происходит в двухатомных молекулах. Однако в многоатомных молекулах имеется множество связей, каждая из которых даёт высокую плотность отрицательно заряженных электронов. Отрицательно заряженные области — связи — отталкиваются друг от друга. Попросту говоря, связи стремятся располагаться как можно дальше друг от друга. Образование связей снижает энергию системы относительно разделённых атомов. Если энергия не снижается, связи не формируются. Но для достижения наименьшей возможной энергии система атомов принимает конфигурацию, которая минимизирует электронное отталкивание за счёт того, что связи располагаются дальше друг от друга.
В молекуле метана тетраэдрическая форма минимизирует отталкивание между связями. Посмотрите на схему, представленную на рис. 14.1 слева. Четыре атома водорода расположены в одной плоскости. Если мы удерживаем их в этой плоскости, они максимально удалены друг от друга. Угол между двумя соседними связями составляет 90°. Если для атомов, располагающихся в этой плоскости, мы увеличим один из углов и сделаем его больше 90°, чтобы ещё сильнее раздвинуть две из водород-углеродных связей, эти связи приблизятся к двум другим связям. Таким образом, если четыре атома водорода удерживаются в одной плоскости с атомом углерода, лучшее, чего можно достичь, — это угол 90° между связями.

