Как уже говорилось, угол, образуемый связями H−N−H, немного меньше угла в правильном тетраэдре (109,5°), поскольку пространственное распределение неподелённой пары электронов несколько шире, чем у связывающей пары электронов N−H, и эта более широкая неподелённая пара подталкивает N−H-связи немного ближе друг к другу. Кислород в молекуле воды H2O имеет шесть валентных электронов. Четыре из них образуют две неподелённые пары, которые не участвуют в химической связи. Кислород использует две свои гибридные sp3-орбитали для образования связей с двумя атомами водорода. Две другие sp3-орбитали заняты неподелёнными парами. Эти две неподелённые пары приводят к тому, что угол HOH оказывается меньше, чем угол в правильном тетраэдре, равный 109,5°(см. 14.2).
Углеводороды с одиночной связью
Углеводороды — это молекулы, целиком состоящие из атомов углерода и водорода. Мы начнём обсуждение более сложных, чем метан, углеводородов с молекул, имеющих лишь одиночные связи. Следующим по простоте углеводородом после метана является этан. Он содержит два атома углерода и шесть атомов водорода, а его химическая формула — C2H6. На рис. 14.9 строение этана представлено тремя способами. Вверху показаны только связи между атомами. Каждый атом углерода имеет одиночные связи с тремя атомами водорода и одиночную связь с другим углеродом. В средней части рисунка показаны гибридные атомные орбитали, обеспечивающие химическую связь. Для создания четырёх связей, совместно использующих электронные пары, каждый атом углерода задействует четыре гибридные sp3-орбитали — так же, как и в метане. Три из этих орбиталей у каждого атома углерода служат для создания связи с тремя атомами водорода. Эти sp3-орбитали объединяются с водородными 1s-орбиталями, образуя связывающие МО, обеспечивающие σ-связи. Четвёртая sp3-орбиталь каждого атома углерода образует МО с sp3-орбиталью другого углерода и порождает углерод-углеродную σ-связывающую МО.
В нижней части рис. 14.9 представлено стандартное схематическое изображение пространственного расположения атомов в молекуле. Атомы, которые связаны и лежат в плоскости страницы, соединяются сплошными линиями. Связанные атомы, которые выступают над плоскостью страницы, соединяются узкими закрашенными треугольниками, острый конец которых направлен на атом в плоскости страницы, а противолежащее ему основание располагается возле атома, выступающего над плоскостью. Связанные атомы, которые лежат за плоскостью страницы, соединяются незакрашенными треугольниками, основание которых прилегает к атому в плоскости страницы, а острый угол указывает на атом, находящийся за этой плоскостью. Из представленного схематического изображения видно, что оба атома углерода находятся в центрах тетраэдров. Между любой парой связей атома углерода имеется характерный для тетраэдра угол, равный 109,5°. Длина C−H-связи составляет 1,07 Å (1,07∙10−10 м), а длина связи C−C — 1,54 Å. Атомы углерода крупнее атомов водорода, поэтому расстояние между центрами двух атомов углерода больше, чем в случае атомов C и H.
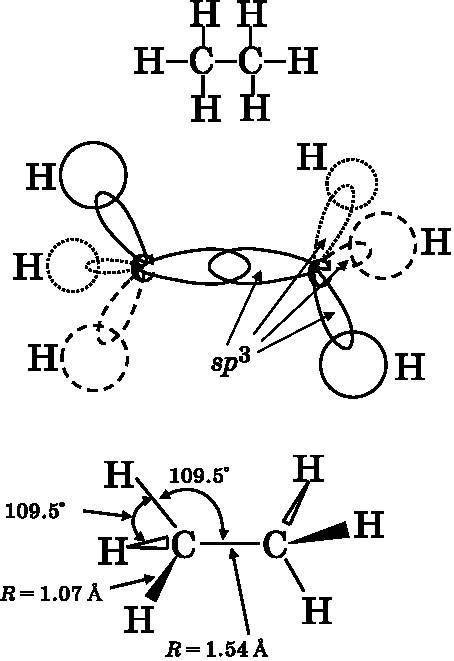
Рис. 14.9.Три схемы молекулы этана C2H6. Вверху: связи между атомами. В середине: каждый атом углерода имеет четыре sp3-гибридизированные атомные орбитали, три из которых связывают с атомами водорода, а четвёртая — с другим атомом углерода. Сплошные кривые лежат в плоскости страницы, штриховые — над плоскостью страницы, пунктирные — за плоскостью страницы. Внизу: пространственное строение молекулы. Линии лежат в плоскости страницы; закрашенные треугольники поднимаются над плоскостью страницы; незакрашенные треугольники уходят за плоскость страницы. Конфигурация связей обоих атомов углерода тетраэдрическая с углом между связями 109,5°. Связь C−C длиннее связей C−H
На рис. 14.10 представлены шаростержневая (вверху) и объёмная (внизу) модели этана. В совокупности на рис. 14.9 и 14.10 приведено пять различных представлений молекулы этана. Лишь объёмная модель даёт близкое к реальности представление о пространственном строении молекулы. Остальные четыре модели преувеличивают для ясности расстояния между атомами. Атомы в шаростержневой и объёмной моделях на рис. 14.10 имеют одинаковые размеры. В шаростержневой модели связи изображены цилиндрами, а атомы отделены друг от друга связями. Важно понимать, что связи возникают за счёт образования молекулярных орбиталей. Электроны совместно используются атомами, которые не отделены друг от друга, как в шаростержневой модели или в других представлениях. Поверхность объёмной модели охватывает бо́льшую часть электронного распределения вероятностей. В объёмной модели атомы окрашены по-разному, чтобы их легче было различать.
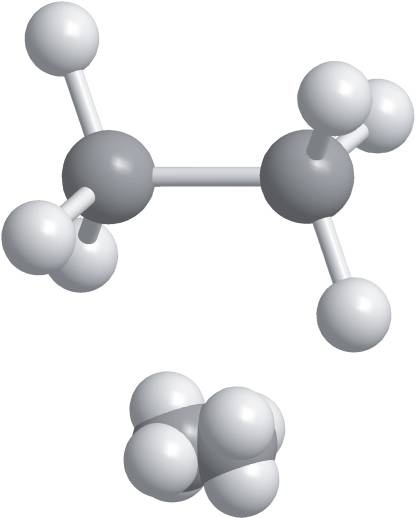
Рис. 14.10.
Модель этана: шаростержневая (вверху) и объёмная (внизу). Атомы в обеих моделях изображаются шарами одинакового размера
Нам понадобится обсудить ещё одну относительно простую молекулу — молекулу пропана, прежде чем углеводороды станут достаточно большими, чтобы начали обнаруживаться некоторые их общие свойства. Пропан состоит из трёх атомов углерода и восьми атомов водорода. Его химическая формула — C3H8. Это формула ничего не говорит о том, как соединены атомы. Её также можно записать в виде H3C−H2C−CH3. При такой записи становится понятно, что атомы водорода соединены с атомами углерода. Атомы углерода соединены друг с другом одиночными связями. Концевые атомы углерода соединены с тремя атомами водорода и одним атомом углерода. Центральный атом углерода соединён с двумя атомами водорода и двумя атомами углерода. На рис. 14.11 приведены два представления молекулы пропана. На верхней диаграмме обозначены связи и углы между ними. Атомы углерода имеют тетраэдрическую конфигурацию связей с углами C−C−C и H−C−H, равными 109,5°. В нижней части рисунка представлена шаростержневая модель пропана.
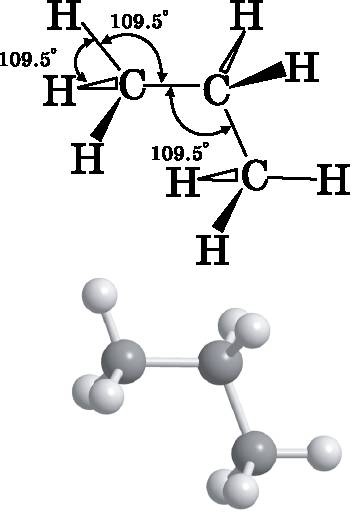
Рис. 14.11.
Диаграмма и шаростержневая модель пропана C
3
H
8
. Атомы углерода находятся в центрах тетраэдров
Большие углеводороды имеют множество структур
Для метана, этана и пропана существует лишь один способ, которым их атомы могут быть связаны друг с другом, и только одна пространственная конформация. Бутан и всё более крупные углеводороды имеют множество структурных конфигураций (способы, которыми атомы связаны друг с другом) и более одной пространственной конформации для конкретной структурной конфигурации. Бутан содержит четыре атома углерода. Его химическая формула — C4H10. Имеется две различные структурные формы бутана. Их называют структурными изомерами. Их молекулы содержат одинаковое число атомов углерода и водорода, но они имеют совершенно разную форму. Бутан может быть н-бутаном, что означает нормальный бутан. Если взять молекулу пропана и добавить к её концу ещё один атом углерода, получится н-бутан. О нём говорят как о линейной цепи, поскольку атомы углерода в нём связаны не более чем с двумя другими атомами углерода — по одному с каждой стороны. Его молекула, как видно из шаростержневой модели, в действительности не является прямой, поскольку каждый атом углерода имеет тетраэдрическую конфигурацию связей, образованных с использованием четырёх гибридных sp3-орбиталей.

