Фармакогеномика
Как мы упрощаем диагнозы, точно так же мы недооцениваем важность персонального генома или то, как он модулирует реакцию на лекарственное лечение. В настоящее время существует немногим более 100 лекарственных препаратов, взаимодействие которых с ДНК признано проверенным и значимым Управлением по контролю за продуктами и лекарствами США42. Вероятно, этот список будет расти; фактически от всех из более чем 6000 рецептурных лекарственных препаратов будет ожидаться реакция, зависящая от ДНК человека. Действительно, все аспекты ответной реакции каждого человека – всасывание, метаболизм, связывание, перенос, выделение – заданы генетически. У нас нет этих данных по 98 % препаратов, но еще хуже то, что при наличии фармакогеномной информации примерно по 100 препаратам мы не используем ее в медицинской практике.
Многие из фармакогеномных взаимодействий ярко выражены, некоторые из них я привожу в табл. 5.142. Отношение шансов
[24] относится к степени эффективности. Таким образом, при лечении литием биполярного расстройства (маниакально-депрессивного психоза) вариант ДНК ассоциируется со 120-кратным увеличением в достижении терапевтического эффекта (исследование проводилось среди ханьцев)43. При лечении гепатита C с помощью интерферона-α наблюдается 38-кратное увеличение эффективности при привязке к варианту гена42. Три других примера относятся к важным побочным эффектам, где вариант последовательности имеет очень большое влияние на риск развития серьезного осложнения.
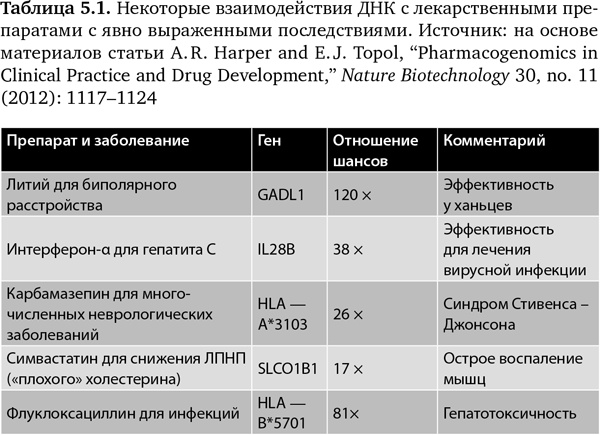
В то время как это очень серьезные последствия, ни одно из них пока не учитывается в клинической практике, по крайней мере в США. На Тайване и в Сингапуре новый рецепт на карбамазепин нельзя выписать, пока не определен риск развития у пациента синдрома Стивенса – Джонсона, потенциально смертельного побочного эффекта. К сожалению, мы имеем наследие из более чем 6000 лекарственных препаратов, которые были выведены на рынок до того, как появились технология или желание определять взаимодействие между ДНК и лекарственными препаратами. Еще больше беспокоит то, что при имеющихся на сегодняшний день возможностях пока очень мало примеров разработки лекарственных препаратов и систематической работы по раскрытию их фармакогеномного действия какой-либо фармацевтической или биотехнологической компанией. В идеале в будущем ГИС человека будет включать исчерпывающую характеристику ожидаемых взаимодействий его организма с лекарственными препаратами.
Период сохранного здоровья
Эталонный геном человека, который рассматривается как золотой стандарт для геномной вариации, имеет один важный недостаток – люди, которых брали для его создания, были молоды и не имели никакого фенотипа. Таким образом, кажущийся нам надежным «якорь», возможно, изъеден ржавчиной. Например, сильная предрасположенность к образованию тромбов приписывается варианту гена, известному как фактор V Лейдена. Но если вы найдете фактор V Лейдена в эталонном геноме, то это фактор V Лейдена! Нам нужен эталонный геном со строгими фенотипичными характеристиками, чтобы избежать этой проблемы. Необходимо собрать большое количество людей с исключительно долгим периодом сохранного здоровья (как в проекте Wellderly, которым мы в Институте трансляционных исследований Скриппса занимаемся на протяжении последних восьми лет) и провести полногеномное секвенирование, тогда мы сможем быть уверены в здоровом эталонном геноме для сравнения.
Но есть еще одна веская причина, объясняющая, почему геномика периода сохранного здоровья будет крайне важна для человеческой ГИС. Мы мало знаем о генах-модификаторах и защитных аллелях – вариантах признака, соответственно отменяющих риск или обеспечивающих фактическую защиту от болезни. Заслуживающим внимания примером является ген АРР (Amyloid Precursor Protein– предшественник бета-амилоида). Один из редких вариантов этого гена ведет к ранней болезни Альцгеймера, но другой, похоже, полностью защищает от развития болезни Альцгеймера вообще – даже у очень пожилых людей, имеющих две копии ароε4. К сожалению, этот защитный аллель АРР встречается весьма редко (менее чем у 0,3 % людей, имеющих европейских предков), но он может служить бесценным уроком от матери-природы, чтобы мы могли разработать лекарственный препарат для профилактики болезни Альцгеймера в будущем. Точно так же редкие варианты липидного гена под названием АроС3 заметно снижают триглицериды в крови и дают 40 %-ное снижение случаев стенокардии44. Более того, бесспорно, имеется большое количество редких вариантов ДНК, которые точно так же снижают риск или дают защиту от болезни, – нам просто нужно их найти! И в конце концов избавиться от того, что можно охарактеризовать как «игноро́м»!45
Молекулярные аутопсии
Каждый день в США от болезней сердца внезапно умирают свыше 100 000 человек. Только 10 % из этих людей удается реанимировать46. Физические аутопсии для определения причин смерти проводятся редко, а даже когда проводятся, многие молекулярные диагнозы просто упускаются, такие как генетические дефекты ионного канала, например синдром удлиненного интервала QТ или синдром Бругада. Не зная причины внезапной смерти члена семьи, его близкие лишены информации о собственных рисках. Родители ребенка, умершего от СВДС (синдрома внезапной детской смерти), часто очень страдают и остаются в неведении о причинах случившегося. Молекулярная аутопсия, состоящая из полногеномного секвенирования покойного, наряду с секвенированием некоторых здравствующих членов семьи может оказаться особенно информативной. Ниже мы поговорим о необходимости и возможности создания подобного глобального информационного ресурса для молекулярных аутопсий.
Человеческая ГИС в перспективе
Путешествие от утробы до могилы дало нам представление о том, на что похоже будущее ГИС – огромное количество широкомасштабной, паноромной информации для каждого человека. Назовем это 10 на 10: 10 инструментов «омов» и 10 остановок на пути продолжительностью в человеческую жизнь. Но это путешествие посвящено не просто ГИС, или чьей-либо ГИС; оно посвящено моей ГИС. Необходимо, чтобы человек владел своей ГИС, а в случае детей это должны быть родители, пока они не передадут право собственности ребенку. Она будет использоваться человеком для того, чтобы сделать важный клинический выбор, как сделала Анджелина Джоли.
Это данные отдельного человека, его медицинская суть, то, что объясняет его устройство, и никто другой не заинтересован в их правильном использовании. Право собственности станет более очевидным благодаря режиму передачи данных по мере того, как ГИС в конечном счете будет поступать к человеку через принадлежащие ему портативные беспроводные устройства. Фактически вся моя собственная геномная последовательность уже введена в мой iPad; все мои данные передаются с устройства на устройство и отражаются на экране смартфона. Однако отображение на экране – это просто опыт конечного пользователя. Как все эти данные будут собираться, храниться и интерпретироваться? Как в конечном счете они докажут свою пользу любому конкретному человеку? Для моей ГИС потребуется облачное хранилище данных. Гораздо важнее сбора и хранения данных возможность проведения предсказательной аналитики. Ниже вас ждет целая глава, посвященная этой увлекательной теме.



