Кроме того, к глутамату очень чувствительна наша вкусовая система. Обычно считается, что есть пять основных вкусов, для которых на языке существуют отдельные типы рецепторов: соленый, кислый, сладкий, горький и выделенный в начале XX века вкус умами. Соленый — это вкус поваренной соли, кислый — протонов (H+), сладкий — сахаров. Горький вкус — самый сложный, он не привязан к какому-то одному классу молекул и возникает как реакция на любое вещество из большой и разнообразной группы зачисленных мозгом в “ядовитые”, это эволюционно выработанный механизм защиты от токсичной пищи. Ну а умами — это не что иное, как вкус глутамата. Судя по всему, в ходе эволюции органов чувств позвоночных животных именно глутамат был выделен как индикатор вкуса белков (важнейших питательных веществ как-никак). Вот почему на языке для него есть особые рецепторы. Ощущение вкуса глутамата — это эволюционно выработанный сигнал о том, что в рот попало нечто белковое.
Глутамат часто добавляют в пищу, причем как в виде кислоты (пищевая добавка E620), так и в виде натриевой соли (пищевая добавка Е621). И раз уж мы заговорили об этом веществе, воспользуемся случаем, чтобы развеять несколько связанных с ним заблуждений. Может быть, кому-то пригодится.
Итак, во-первых, утверждение, что глутамат — усилитель вкуса, неточно. Выражение “усилитель вкуса” могло бы относиться к некоему (вымышленному) веществу без собственного вкуса и запаха, обладающему свойством обострять вкус любой еды. Глутамат этого не делает: у него просто есть свой вкус, точно так же, как у сахара или у соли. Механизмы восприятия вкуса глутамата и вкуса, допустим, того же сахара принципиально не отличаются друг от друга. Просто сахар воспринимается одними рецепторами, а глутамат — другими.
Во-вторых, неверно часто встречающееся мнение, будто “натуральный” глутамат (предположительно безобидный) — это совсем не то, что глутамат “искусственный” (предположительно вредный и опасный). Люди, которые так думают, просто не знают, о каком веществе идет речь. А мы с вами теперь знаем. Глутамат — это не какая-нибудь загадочная сложная смесь (состав которой действительно мог бы варьироваться), а одно-единственное химическое соединение, описываемое незатейливой формулой. Вот она, эта формула: HOOC–CH2–CH2–CH(NH2)–COOH. Только и всего. Глутамат, полученный искусственно, не отличается от полученного готовым из природных продуктов, потому что отличаться там нечему.
В-третьих, глутамат, получаемый с пищей, едва ли опасен для нервной системы прежде всего потому, что он в нее почти не проникает — это обеспечивается специальным физиологическим барьером. Нервные клетки синтезируют глутамат самостоятельно. К тому же в белковых продуктах (таких, как творог, мясо или соя) глутамата наверняка больше, чем попадает его в еду в качестве пищевой добавки, — просто потому, что это составная часть любых белков.
В-четвертых, на глутамат нет аллергии
[28]. Аллергию вызывают чужеродные вещества, а не такие, которые жизненно необходимы и всегда присутствуют в организме в высоких концентрациях, — а глутамат как раз относится к последним.
Так что опасность глутамата — это, судя по всему, типичный современный миф.
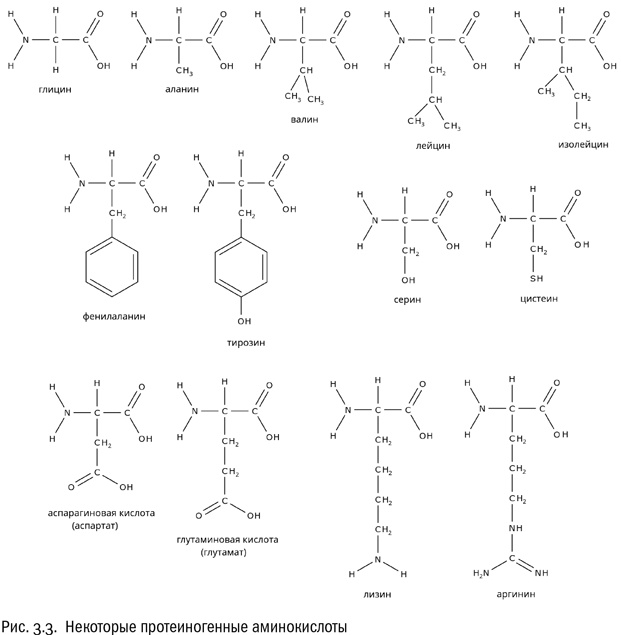
Однако вернемся к другим аминокислотам. Если есть отрицательно заряженные аминокислоты, логично ожидать, что существуют и положительно заряженные. Это действительно так. Пример положительно заряженной аминокислоты — лизин, имеющий формулу NH2–CH2–CH2–CH2–CH2–CH(NH2)–COOH. Как видим, у лизина в радикале есть дополнительная аминогруппа, которая ведет себя так, как аминогруппе и положено: приобретает протон. Еще одна положительно заряженная аминокислота — аргинин, радикал которого включает довольно редкую (больше она нам нигде не встретится) гуанидиновую группу –NH–C(NH)–NH2, тоже охотно присоединяющую протон.
Таким образом, аминокислоты, из которых состоят белки, можно поделить на четыре категории: гидрофобные, гидрофильные нейтральные, положительно заряженные и отрицательно заряженные. Разумеется, все эти различия касаются только той части молекулы аминокислоты, которую мы назвали радикалом (R). “Базовая” часть (включающая атом углерода, атом водорода, карбоксильную группу и аминогруппу) во всех рассмотренных нами протеиногенных аминокислотах одна и та же. Особое положение занимает разве что самая простая из всех возможных аминокислот — глицин, у которого вместо радикала атом водорода.
Аминокислоты и связи
Итак, любой белок — это полипептид, то есть цепочка аминокислот, соединенных пептидными связями. На самом деле теоретически можно придумать полипептид, не являющийся белком, но мы сейчас поступим проще и будем считать, что эти слова — синонимы. В подавляющем большинстве тех случаев, которые нам могут встретиться, так оно и есть.
Для начала представим, что молекулу полипептида бросили в воду. Очевидно, что она не останется там вытянутой в прямую линию, а будет как-то сворачиваться. Это сворачивание будет зависеть от взаимодействия аминокислотных остатков как с молекулами воды, так и между собой. В целом пептидная цепь устроена довольно просто: ее “скелет” образуют пептидные группы, соединяющие между собой альфа-атомы углерода, а радикалы торчат в стороны. Все эти части огромной молекулы как-то размещаются в пространстве относительно друг друга, и в результате белок приобретает свою трехмерную форму — как обычно говорят, конформацию. Белок с нарушенной конформацией, как правило, совершенно бесполезен для организма. Поэтому соблюдение конформации — это очень важно.
Как же она складывается? Есть четыре типа взаимодействий между аминокислотами, определяющих объемную структуру белка, в который они входят.
Во-первых, это водородные связи (см. главу 2). В белке их обычно много, они возникают и между пептидными группами, и между боковыми цепями аминокислот (“боковая цепь” и “радикал” — в данном случае синонимы). Особенно это относится к тем аминокислотам, радикалы которых нейтральны и гидрофильны — вроде, например, серина или тирозина.
Во-вторых, это гидрофобное притяжение между углеводородными радикалами, принадлежащими таким аминокислотам, как валин, лейцин или фенилаланин. Вода выталкивает эти радикалы точно так же, как вытолкнула бы обычные молекулы углеводородов, и они отлично слипаются вместе, если оказываются при сворачивании белковой молекулы близко друг к другу. А тем самым они это сворачивание и закрепляют.
В-третьих, существует электростатическое притяжение между положительно и отрицательно заряженными боковыми цепями. Если, например, глутамат (радикал которого заряжен отрицательно) окажется при сворачивании белка рядом с лизином (радикал которого заряжен положительно), между ними тут же возникнет самая настоящая ионная связь.



