
Онлайн книга «Имя ему СПИД. Четвертый всадник Апокалипсиса»
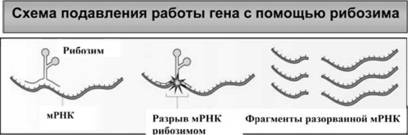
Рис. 32. Подавление вирусной инфекции с помощью рибозимов основано на их способности связываться с определенными участками вирусной мРНК и разрезать ее на куски. B результате исчезновения целостной полноразмерной мРНК синтез соответствующего ей белка происходить не может. Это предотвращает размножение вируса
Серьезные надежды возлагаются в последнее время еще на одно очень интересное направление — избирательное подавление синтеза вирусных белков с помощью механизма РНК-интерференции. B связи с этим сделаем небольшое, но важное отступление.
Давно было известно, что в клетках существует специальный механизм, который мешает распространению вирусной инфекции. Он даже получил свой термин — интерференция. Белки, которые участвуют в этом процессе, были названы интерферонами. B ответ на введение в клетки фрагментов нуклеиновой кислоты длиной более тридцати нуклеотидов (геном всех вирусов имеет больший размер) в их цитоплазме запускается мощный интерфероновый ответ, блокирующий весь белковый синтез (т. е. в данном случае происходит защитный ответ клетки на вирусную инфекцию, который является не специфическим на определенный агент, а общим). И вот недавно открыт совершенно новый способ регуляции работы генов в клетках — механизма РНК-интерференции. Выяснилось, что в клетке существует специальный механизм, способный деградировать строго определенные РНК (без участия рибозимов) и таким образом полностью инактивировать ее. Этот механизм деградации может быть направлен на любую конкретную РНК — клеточную, бактериальную или вирусную. Суть механизма РНК-интерференции заключается в том, что при введении в клетки короткой двуните-вой РНК (днРНК) она способна вызывать специфическое разрушение той мРНК, с которой имеет гомологию. Как теперь выяснено, сначала днРНК разрезается специальным ферментом на короткие фрагменты размером от 19 до 21 пар нуклеотидов. После небольших химических модификаций эти короткие днРНК образуют специфический комплекс с определенными клеточными белками. B этом комплексе днРНК расплетается и становится однонитевой. Затем короткая однонитевая РНК в силу своей комплементарности взаимодействует со строго определенной мРНК (копией гена-мишени), что является сигналом для «разрезания» последней ферментами комплекса. Образующиеся в результате этого короткие фрагменты мРНК уже неспособны обеспечивать синтез полноценного белка. Таким образом, конструируя различные днРНК, можно подавлять синтез строго определенных белков в клетке, не изменяя при этом структуру кодирующих их генов.
Открытие РНК-интерференции имело большое значение для всей теоретической молекулярной генетики. Но, как и большинство других крупных открытий, сразу же возникла идея о применении новой технологии в человеческой практике и, в частности, для лечения различных заболеваний. Вполне естественно, что вскоре стали размышлять над использованием этого природой созданного свойства — интерференции — и для борьбы с ВИЧ (рис. 33). Первые попытки применить РНК-интерференцию в качестве нового подхода к терапии ВИЧ-инфекции появились в 2002 г. Для того чтобы использовать механизм РНК-интерференции в клетках млекопитающих, внутрь клеток нужно ввести уже готовые двухцепочечные молекулы РНК. Оптимальный размер таких синтетических РНК составляет те же 21–28 пар нуклеотидов. Если увеличить ее длину — клетки ответят выработкой интерферона и снижением синтеза белка. Но молекулы РНК синтезировать трудно, они не очень стабильны. Поэтому на практике пользуются возможностями, предоставляемыми рекомбинантными ДНК, которые, будучи перенесенными в клетки, обеспечивают синтез таких днРНК.
С целью воздействия на ВИЧ сейчас уже опробовано несколько вариантов РНК-интерференции. Если первоначально для подавления вируса использовали интерферирующие РНК к вирусным мРНК, то в дальнейшем пришли к выводу, что более целесообразным является направлять днРНК на клеточные мРНК, такие как, например, мРНК, кодирующие вирусный рецептор CD4 и/или корецептор CCR5. Дело в том, что вирусные гены быстро видоизменяются, соответственно изменяется нуклеотид-ная последовательность вирусной РНК. В результате этого конкретная искусственно синтезированная интерферирующая РНК очень быстро становится малоэффективной к некоторым вариантам вируса. Клеточные же гены, обеспечивающие взаимодействие вируса с клеткой, стабильны (они изменяются чрезвычайно редко). По этой причине подавление их работы с помощью интерферирующих РНК происходит более надежно. Внимание было обращено на клеточные белки-рецепторы или корецепто-ры для ВИЧ. Если предотвратить синтез хотя бы одного из них, вирус не сможет проникать в клетку. На клетках, которые растут вне организма (in vitro), уже были использованы обе стратегии, и все они дали существенный положительный результат. Так, показано полное подавление инфицирования ВИЧ макрофагов с помощью комбинации коротких интерферирующих днРНК, направленных против клеточных и вирусных генов. Однократное применение днРНК обеспечивало долгосрочную защиту этих неделящихся клеток от вируса. Обнаружена также возможность подавления размножения ВИЧ в уже инфицированных клетках. Использование интерферирующих РНК имеет целый ряд преимуществ по сравнению с антисмысловыми РНК (большая эффективность, меньшая токсичность).
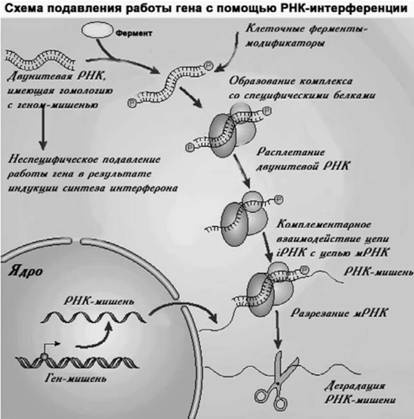
Рис. 33. После появления искусственной двунитевой РНК в клетке там происходят разнообразные ее изменения (химические модификации, расплетание нитей). Далее одна из нитей этой РНК образует гибрид с той мРНК, на которую она изначала была «направлена». А в конечном итоге специальные ферменты, узнающие образовавшийся комплекс РНК1-мРНК, разрезают содержащуюся в нем мРНК, чем вызывают прекращение синтеза белка, который кодирует эта мРНК. Маленькие интерферирующие РНК (РНК1) — новый важный инструмент в руках генных терапевтов. В случае ВИЧ-инфекции РНК могут быть направлены на разные процессы жизненого цикла ВИЧ
Однако до практического применения этой новой технологии к человеку пока еще дело не дошло. Трудность заключается в том, что двунитевые РНК очень нестабильны и быстро разрушаются в организме. Кроме того, надо обеспечить присутствие этих РНК главным образом в клетках, пораженных вирусом, а не вообще в организме. На сегодняшний день еще нет надежных способов доставки генов и РНК в отдельные клетки, не отработаны до конца приемы, обеспечивающие длительное пребывание РНК в организме. Но нет сомнения, что такие приемы и методы вскоре будут созданы.
Большинство экспертов сходится во мнении, что терапия малыми двунитевыми РНК вряд ли станет панацеей от вирусов и других заболеваний. Однако создание на ее базе пусть даже не радикального, но все же действенного лекарственного средства будет очень важным шагом на пути разработки методов генной терапии.
Вполне возможно, что для борьбы с ВИЧ может быть использовано давно уже известное явление интерференции, происходящее иногда между вирусами. Еще в 1935 г., изучая инфекцию, вызываемую двумя штаммами (вариантами) вируса желтой лихорадки у обезьян, англичанин М. Хоскинс описал защитный эффект, не обусловленный иммунной реакцией. Суть интерференции заключается в том, что если в клетке уже есть какой-либо вирус, то другому вирусу туда проникнуть уже значительно сложнее.
