
Онлайн книга «Справочник педиатра»
При абортивной форме заболевания клиника выражена нерезко и проявляется частыми респираторными заболеваниями и нарушениями со стороны желудочно-кишечного тракта.
Диагноз. Надежной является потовая проба – определение содержания электролитов (хлора и натрия) в отделяемом потовых желез. У здоровых детей их концентрация не превышает 40 ммоль/л; при муковисцидозе содержание хлора (или натрия) в поту колеблется в пределах 50-180 ммоль/л. Для выявления сниженной протеолитической активности кала применяют ренттенопленочный тест (переваривание суспензией кала желатина рентгеновской пленки). При копрологическом анализе выявляется стеаторея.
Для целей массового обследования новорожденных может применяться мекониальный тест на альбумин, содержание которого определяют с помощью цветной реакции или (лучше) иммунохимическим методом. Дети, у которых содержание альбумина в меконии превышает 20 мг/г сухой массы, считаются подозрительными по муковисцидозу и подлежат специальному обследованию (потовая проба) и диспансерному наблюдению.
Дифференциальный диагноз проводят с коклюшем, астматическим бронхитом, бронхоэктазией, целиакией, дисахаридазной недостаточностью.
Лечение при муковисцидозе строится в зависимости от клинической формы заболевания и степени выявленных при обследовании функциональных и органических нарушений. Большое значение имеет диета с повышенным количеством белка, ограничением жиров и мучнистых углеводов. Жирорастворимые витамины (ретинол, эргокальциферол, викасол) назначаются в двойной дозе. В основе терапии кишечных форм лежит применение ферментов, главным образом панкреатина, в больших индивидуальных дозах. Проводятся гормонотерапия, трансфузии плазмы крови, ЛФК и т. д. В случаях пневмонии назначается терапия, обычно применяемая при обострении хронических бронхолегочных процессов. Препараты вводятся преимущественно в виде аэрозолей, обязательны стимулирующие, физиотерапевтические и другие мероприятия. Показаны муколитики. Эффективен N-ацетилцистеин (флюимугил, мукосальвин), который в виде 6 % раствора используется для ингаляций, а также для внутримышечного введения. Прогноз остается серьезным, летальность достигает 50 %.
В литературе также используются другие названия данного заболевания: кишечный инфантилизм, идиопатическая стеаторея, глютеновая болезнь, глютеновая энтеропатия.
Этиология. Врожденное заболевание, обусловленное дефицитом ферментов, расщепляющих белок злаков глиадин до аминокислот. Следствием этого является накопление в организме токсических продуктов неполного гидролиза белка. Нарушение пищеварения вызывается повреждением ворсинок тонкой кишки пищевыми продуктами, содержащими глютен (клейковина), и близкими к нему белками злаков (авенин, гордеин и др.)» содержащимися в пшенице, ржи, ячмене и овсе.
Целиакия наследуется по аутосомно-доминантному типу.
Клиника. Среди клинических вариантов следует выделять истинную целиакию и синдром целиакии, который может развиться при самых разнообразных заболеваниях кишечника. Начало целиакии нередко совпадает с введением в пищевой рацион ребенка прикормов, содержащих мучные изделия. Поэтому заболевают чаще дети 6-12 месяцев. Появляется учащенный пенистый стул, обильный, с резким запахом, светлый или с сероватым оттенком, жирный. Лечение диспепсии обычными средствами (антибиотики, ферментные препараты, редукция в питании и др.) эффекта не дает. Ребенок становится вялым, бледным, теряет массу тела, снижается аппетит. Постепенно развивается дистрофия, и дети приобретают типичный для целиакии вид: резкое истощение, потухший взгляд, яркие слизистые оболочки, огромных размеров живот. В ряде случаев развиваются отеки на нижних конечностях, нередки спонтанные переломы костей. Определяется псевдоасцит (скопление жидкости в атоничном кишечнике). Далее присоединяются симптомы поливитаминной недостаточности (сухость кожи, стоматит, дистрофия зубов, ногтей, волос и др.).
При длительном течении целиакии имеет место универсальная мальабсорбция. Дети страдают не только физически, но и психически (лабильность настроения, замкнутость, повышенная возбудимость, негативизм). Течение болезни волнообразное. Иммунитет у больных снижен, поэтому они склонны к интеркуррентным заболеваниям, которыми болеют тяжело.
Диагноз часто ставится с большим опозданием, его уточнение возможно при тщательном копрологическом исследовании (наличие в кале большого количества жирных кислот и мыл), биохимическом исследовании крови (гипопротеинемия, гипоальбуминемия, снижение концентрации холестерина и липидов, гипокальциемия, гипофосфатемия, гипосидеринемия и др.)» рентгенологическом исследовании (остеопороз, горизонтальные уровни в петлях кишок, дискинезия кишечника). Окончательный диагноз устанавливается после биопсии слизистой оболочки тонкой кишки.
Дифференциальный диагноз проводят с кишечной формой муковисцидоза, дисахаридазной недостаточностью, аномалиями желудочно-кишечного тракта.
Лечение. Основа лечения – строгое соблюдение диеты. Полное исключение из рациона продуктов, содержащих муку и зерна злаковых культур, а также ограничение жиров (особенно животных) и сахара. Из жиров предпочтительно кукурузное и подсолнечное масло. Запрещается употребление блюд, содержащих примеси муки (паштет, фарш, сосиски, колбаса, соусы).
Медикаментозная терапия направлена на коррекцию метаболических нарушений, развившихся вследствие нарушенного кишечного всасывания.
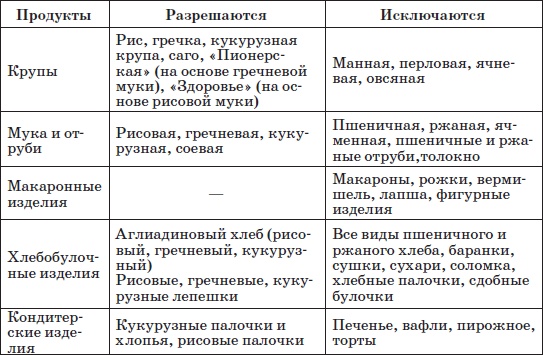
Таблица 29 Набор разрешенных и запрещенных зерновых продуктов при целиакии
Этиология. Экссудативная энтеропатия – это заболевание, которое характеризуется повышенной потерей плазматических белков через желудочно-кишечный тракт, что приводит к белковому дефициту и другим метаболическим расстройствам. Различают первичную (наследственную) и вторичную (приобретенную) экссудативную энтеропатию. Первичный синдром экссудативной энтеропатии связан с врожденным дефектом лимфатических сосудов кишечной стенки с развитием лимфангиэктазий, выявляемых при морфологическом исследовании. Вторичный синдром наблюдают при целиакии, муковисцидозе, болезни Крона, неспецифическом язвенном колите, циррозе печени и ряде других заболеваний.
Клиника развивается остро после года и складывается из ряда симптомов: отеки, задержка физического развития, диарея, снижение массы тела. Не исключается транзиторное и хроническое течение. Гипопротеинемия развивается в короткие сроки, так как синтез альбумина печенью не восполняет потери из кровяного русла в просвет кишечника. Гипопротеинемия – главный фактор развития отечного синдрома. Повышенная потеря плазменных белков через желудочно-кишечный тракт может приводить к состоянию гипогаммаглобулинемии с резким снижением уровня иммуноглобулинов всех классов, резко снижает общую сопротивляемость детей к инфекциям и обусловливает затяжное течение инфекционных заболеваний. У детей раннего возраста появляются судороги, вызванные гипокальциемией. Приступы тетанических судорог усугубляются явлениями гипомагнезиемии. Постоянный клинический симптом – стеаторея, обусловленная нарушениями всасывания и транспорта жиров. Мышечная гипотония, нарушения сердечной деятельности, изменения ЭКГ связаны с развивающейся гипокалиемией. Комплекс тяжелых метаболических нарушений, в первую очередь дисбаланс в белковом обмене, приводит к снижению весоростовых показателей, отставанию костного возраста ребенка.
