Они почти целиком состоят из белков и ДНК (рис. 4.8). Будучи вирусами, они не могут жить без хозяина. Ввиду простоты своего устройства они оказываются идеальными испытуемыми для получения сведений о жизнедеятельности и их самих, и их хозяев.
Хамилтон Смит, микробиолог из университета Джонса Хопкинса
[9] в конце 1960-х работал с Haemophilus influenzae Rd и фагом Р22. Случайно бактерии и фаги стали выращивать вместе. Смит заметил, как активность ДНК у фага все время падала, что указывало на расщепление ДНК фага чем-то внутри бактерии. Смит со своими сотрудниками выделил и очистил ответственный за расщепление фермент и установил его механизм: белковый фермент внутри Н. influenzae расщепляет ДНК фага, выявляя определенную цепь из шести парных оснований и расщепляя ДНК — неизменно в одном и том же месте и одним и тем же способом. Такой фермент получил название рестрикционного. Помимо этого фермента Н. influenzae Rd располагает еще одним ферментом, четилазой, защищающей ДНК бактерии от подобной участи. Фермент метилаза присоединяет метиловую группу к нуклеотидным основаниям цитозина или аденина в ДНК бактерии. Метилирование настолько изменяет молекулу ДНК, чтобы рестрикционный фермент все еще мог распознать место своего подсоединения, не вмешиваясь при этом в обычный ход воспроизводства или метаболизма самой бактерии.
С тех пор удалось открыть тысячи ферментов, расщепляющих ДНК на определенных участках. Отрыты были и ферменты, скрепляющие вместе куски ДНК. В итоге всех этих открытий молекулярные биологи располагают ныне набором белковых ферментов, позволяющих им разрезать или склеивать ДНК в заданных местах.
Сенгеровский метод обрыва цепи [замещающим нуклеотид] дидезокси [рибонуклеозидтрифосфатом] для секвенирования ДНК.
В 1977 году биохимик из Великобритании Фред Сенгер разработал способ расщепления ДНК на участки, соответствующие любой длине исходной ДНК. Этот метод использовал замещающую нуклеотид молекулу. Заместитель не образует связи со следующим нуклеотидом в последовательности, необходимой для создания всей ДНК, так что цепь обрывается на нем.
Приведем пример. На рис. 4.9 верхняя молекула имеет атом кислорода, связанный с атомом водорода в положении 3 (атомы углерода в кольце нумеруются цифрами 1 , 2 , 3 , 4 и 5 ), тогда как у атома водорода в положении 4 атом кислорода отсутствует (отсюда приставка дезокси-). У нижней молекулы атом водорода отсутствует на позициях 3 и 4 , поэтому ее название начинается с приставки диде-зокси-. Из-за такой разницы в строении, когда при сборке молекулы ДНК в нее встраивается дидезоксидное основание, она уже не связывается с другим нуклеотидным основанием (в позиции 5 ), и цепь ДНК обрывается в этом месте. То же происходит с другими основаниями ДНК (аденином, гуанином и цитозином). В итоге можно получать ДНК различной длины (на изображениях молекул пустые углы на кольцах соответствуют атомам углерода).
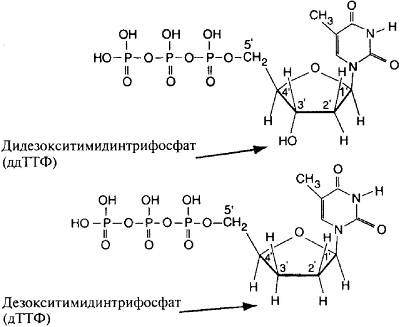
Рис. 4.9. Дезокситимидинтрифосфат (дТТФ) и дидезокситимидинтрифосфат (ддТТФ)
Сенгеровский метод обрыва цепи дидезоксидными основаниями для секвенирования ДНК начинается с того, что посредством рестрикционных ферментов расщепляют подвергаемую секвенированию ДНК на меньшие участки, а ДНК нагревают до полного разделения обеих ее нитей. Затем к этим однонитевым участкам ДНК добавляют трифосфаты с дидезоксидным основанием, после чего вводится белковый фермент ДНК полимераза, который приступает к сборке копий исходной ДНК. Из-за дидезоксидных оснований собранные молекулы представляют собой не копии исходной ДНК, а смесь из полученных прежде участков ДНК. Предварительно дидезоксидные основания помечаются (маркируются) либо радиоактивным изотопом фосфора, либо чувствительным к ультрафиолетовому свету красителем, так что конец каждой оборванной цепи становится видимым.
Затем эту смесь цепей ДНК помещают в лунки пластины геля и дают электрическое напряжение. Более короткие участки испытывают меньшее сопротивление среды (обычно желе из водоросли агароза, схожее с желатином «Джелло»
[10] вещество, с той лишь разницей, что молекулы там образуют дополнительные связи, делая гель прочным) и поэтому движутся быстрее. Часто в качестве образца в одну из лунок помещают цепи известной длины. После достижения наиболее короткими цепями края пластины геля напряжение снимают. По радиоактивным или флуоресцентным маркерам определяют нуклеотидное основание в конце каждой молекулярной цепи. Поскольку электрофорез распределяет молекулы в соответствии с возрастанием длины цепи, при просмотре виден порядок расположения парных оснований нуклеотидов в исходной ДНК.
Данный метод широко применялся до середины 1980-х годов, и работа над диссертацией у многих аспирантов заканчивались участием в многолетнем проекте по секвенированию определенной части ДНК одного из модельных организмов. Приходилось брать пробы у организма, очищать, смешивать с химическими реактивами, выращивать, помещать в гель и проводить исследование, после чего собирать и толковать данные. Работа была тяжелой и продвигалась медленно. Обычно в ходе написания диссертации удавалось выстроить участок в 40 тыс. парных оснований ДНК.
Секвенирование генома человека
Озвучивая мнения многих влиятельных биологов, в номере Science за 7 марта 1986 года Ренато Дульбекко, глава Института биологических исследований им. Солка,
[11] призвал к претворению в жизнь грандиозной программы по расшифровке генома человека. Он доказывал, что столь огромные усилия необходимы для понимания роли генов в развитии рака. Некоторые биологи, вроде Уолтера Гилберта (известного гипотезой РНК — мира), с радостью восприняли это предложение. Гилберт сказал: «Полный геном человека — Грааль генетики человека» (подробнее об этом сравнении далее).
Другие выразили озабоченность, что подобный гигантский проект исказит биологию до неузнаваемости. Расшифровка 3 млрд. пар азотистых оснований с помощью имеющихся на тот час средств потребует 15 — летней непрерывной работы 10 тыс. аспирантов и обойдется примерно в 3 млрд. долларов. При таких затратах человеческих и денежных ресурсов ничего не останется на все остальные биологические проекты.



