Периодическая таблица элементов.
Новые элементы с их измеренными атомными весами начали демонстрировать интересную регулярность своих свойств. Британский химик Джон Ньюлендс (1837–1898) заметил, что если расположить элементы в соответствии с их атомными весами, то химические свойства начинают повторяться через семь элементов. Он назвал это «законом октавы», но музыкальная аналогия не усилила доверия к идее. Поскольку в то время еще не было известно о благородных газах, в каждом ряду из семи элементов не хватало одного.
Периодическую систему химических элементов предложил Дмитрий Менделеев в двухтомном учебнике «Основы химии» (1868–1870). Менделеев вырос в Тобольске, в Сибири. Он был четырнадцатым ребенком учителя тобольской гимназии. Высшее образование получил в Санкт-Петербурге и Париже. В 1863 году стал профессором химии в Санкт-Петербургском университете (рис. 16.3).

Рис. 16.3. Дмитрий Иванович Менделеев (1834–1907).
С помощью своей таблицы Менделеев смог предсказать новые элементы, заполнив пробелы в системе. Первым элементом, подтвердившим его прогноз, стал открытый в 1875 году галлий. Независимо от Менделеева похожую систему разработал немецкий химик Лотар Мейер (1830–1895).
Врезка 16.1. Периодическая таблица и атомные веса первых 56 элементов.

Жирным шрифтом указаны элементы, открытые после Менделеева. Полную современную версию этой таблицы можно найти на сайте http://www.chemicool.com/.
Английский химик Уильям Праут (1785–1850) еще в 1815 году предположил, что атомы состоят из более мелких единиц. Такой единицей, по-видимому, является атом водорода. Однако некоторые атомные веса не кратны атомному весу водорода, например, атом хлора весит 35,5 в единицах веса атома водорода (Врезка 16.1). Эту проблему разрешил в 1913 году Фредерик Содди (1877–1956). Он обнаружил изотопы, то есть химически одинаковые атомы, имеющие разный вес. Например, выяснилось, что атомы хлора бывают двух видов: 77,5 % из них весят 35,0 единиц, а 22,5 % весят 37,0 единиц числа, почти точно равного весу атома водорода. Среднее значение для хлора равно 35,5 единицам.
Хотя пустые клетки в таблице Менделеева постепенно заполнялись, оставалось неясным, все ли элементы в точности укладываются в эту систему. Почему бы не предположить, например, что между водородом (атомный вес 1) и гелием (атомный вес 4) существует еще один или два элемента. До 1913 года, когда Генри Мозли (1887–1915) предложил атомные номера, не существовало точного определения элемента. Мозли работал в Манчестерском университете, где изучал рентгеновские лучи. Исследуя рентгеновское излучение разных элементов, он выявил целые атомные номера для каждого элемента. Вскоре после этого открытия молодого ученого призвали в армию, и он погиб в битве при Галлиполи.
Согласно измерениям Мозли, атомное число кальция равно 20. Поскольку это же порядковый номер кальция в периодической таблице, то очевидно, что неизвестных элементов легче кальция в таблице нет. Во времена Мозли не хватало четырех атомных номеров, но соответствующие элементы с тех пор были обнаружены. Периодическая система сейчас содержит 117 известных элементов, 94 из которых формируются на Земле естественным путем. Нептуний (93) и плутоний (94) найдены на Земле в следовых количествах. Более тяжелые элементы очень нестабильны и производятся искусственно в ускорителях частиц. Самый легкие из них — технеций (43) и прометий (61), они очень редко встречаются на Земле и тоже входят в эту группу искусственных элементов.
Открытие электрона.
Атомное число оказалось связано с электрическими характеристиками атома; впервые это обнаружилось в процессе электролиза. Этот метод открыли в 1800 году Уильям Николсон и Энтони Карлайл, которые опустили в воду два провода, присоединенные к разным полюсам электрической батареи. При этом они обнаружили, что вокруг отрицательного электрода начал выделяться газообразный водород, а вокруг положительного электрода — кислород. Стало очевидно, что в этом процессе молекулы воды расщепились на составные элементы (рис. 16.4).
Гемфри Дэви экспериментировал с электролизом, а его коллега по Королевскому институту Майкл Фарадей дал следующее объяснение этому явлению: малая часть молекул воды всегда диссоциирована на две электрически заряженные группы — на атомы водорода с положительным зарядом и на молекулы, состоящие из водорода и кислорода, с отрицательным зарядом. Фарадей назвал эти заряженные частицы «ионами». Провод, соединенный с отрицательным электродом, притягивает положительно заряженные ионы водорода. Касаясь провода, они отбирают у него отрицательный заряд и превращаются из ионов в нейтральные атомы водорода. После этого водород начинает пузырями выходить из воды. Немного более сложный процесс происходит с кислородом у провода, соединенного с положительным полюсом батареи.
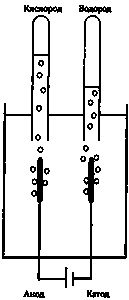
Рис. 16.4. Электролиз. Два провода соединены с источником постоянного тока (батареей) и помещены в воду. На положительном электроде (аноде) выделяется газообразный кислород и собирается в трубке, а на катоде выделяется водород. Как показал Фарадей, количество выделившегося газа прямо пропорционально величине электрического заряда, прошедшего через провод. Кроме того, согласно закону Авогадро объем водорода вдвое превышает объем кислорода.
Заряд, передающийся атомам жидкости, замещается новым зарядом посредством тока, текущего от электрической батареи. Собрав и изучив возникшие в этом процессе газы, можно определить количество газа на единицу заряда этого тока. Имея дело с водородом, мы можем вычислить отношение массы к заряду у ионов водорода. Если в качестве единиц массы и заряда использовать килограммы и кулоны, то это отношение примерно равно 10-8. При этом невозможно по отдельности определить массу и заряд, но только лишь их отношение.
Мы можем определить массу иона водорода, играющего роль единицы атомного веса, если узнаем его заряд, но во времена Фарадея это было невозможно. Неясно было, какие частицы несут заряд. Для единичного заряда при электролизе в 1874 году Джордж Стоней предложил название электрон. Частицы с таким зарядом (и названные так же) открыл в 1897 году Джозеф Томсон (рис. 16.5).

Рис. 16.5. Джозеф Томсон (1865–1940), открывший электрон.
Томсон учился в Кембриджском университете и, заняв вторую ступень на экзамене по математике, обеспечил себе место в Тринити-колледже, где работал и Ньютон. Всю оставшуюся жизнь Томсон трудился в этом колледже и под конец стал его ректором. Томсон начинал как математик, поэтому его назначение в 1884 году в Кавендишскую лабораторию на должность профессора экспериментальной физики оказалось неожиданным. Он никогда не занимался экспериментами; один из его ассистентов говорил, что «у него были очень неуклюжие руки, поэтому я старался держать его подальше от эксперимента». Тем не менее Томсон стал одним из ведущих физиков-экспериментаторов, поскольку обладал интуицией в выборе направления исследований.






