На эффекте туннелирования основан и синтез гелия в недрах Солнца, дающий такой любимый нами солнечный свет. Ядра гелия образуются при объединении ядер водорода — протонов, которые должны сблизиться настолько, чтобы их связало сильное ядерное взаимодействие. Сближению протонов мешает их электрическое отталкивание, преодолеть которое протоны могли бы при очень высокой скорости движения. Но в недрах Солнца их скорости довольно малы. Как же разрешается эта дилемма? Поскольку протоны тоже «размазаны» вблизи своего среднего положения, временами они материализуется ближе друг к другу, чем на это указывает их среднее положение. Так что протоны, к своему удивлению, вдруг могут оказаться в области сильного ядерного взаимодействия, хотя ожидать этого было невозможно.
Рассмотрим теперь такой случай. Мы сильно бьем в кирпичную стену дома теннисным мячом. Неожиданно мяч проходит сквозь стену и оказывается внутри здания. А в стене как не было дырки, так и нет; мяч туннелировал сквозь стену. То, что этого никогда не может произойти, обусловлено большой массой теннисного мяча по сравнению с массой протона! Теперь понятно, почему электрон не может быть составной частью ядра. Как легкая частица, электрон размазан по такой большой области, что не может удержаться в ловушке внутри ядра.
Структура атомов.
Развитие квантовой теории позволило понять структуру атома: почему атомы каждого элемента обладают характерными химическими свойствами, как атомы объединяются в химические соединения и многое другое. Вычисления в квантовой механике основаны на уравнении Шредингера, выведенном в 1926 году австрийцем Эрвином Шрёдингером, работавшим тогда в Цюрихе (см. рис. 17.3). Поскольку тогда уже было ясно, что электроны можно рассматривать как волны, Шредингер представил электроны в атомах как колебательное явление. Он показал, что только определенные виды колебаний могут длиться долго, как у музыкального инструмента с долго звучащей отдельной нотой. «Ноты» в атоме соответствуют электронным орбитам Бора (рис. 17.4).
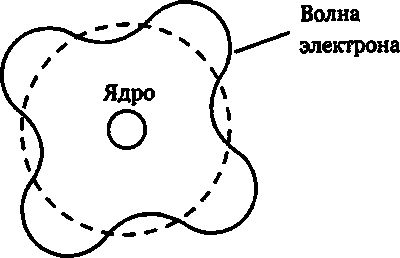
Рис. 17.4. Волны электронов, циркулирующие вокруг атомного ядра. Если на одном обороте укладывается целое число волн, то волна усиливается и возникает разрешенная электронная орбита. Если фазы волны после одного оборота не совпадают, интерференция приводит к их затуханию. Поэтому в модели Бора такой орбитальный радиус невозможен.
Модель Бора для атома водорода далее была развита в оболочечную модель атома, которая объясняет периодическую систему элементов. Вместо предложенных Бором орбит мы сейчас говорим об оболочках атома. Элементы тяжелее водорода имеют несколько электронов, находящихся в разных оболочках. Но электроны не могут свободно выбирать оболочку, в которой они могли бы находиться; в наиболее спокойном состоянии оболочки атома заполняются электронами снизу вверх (от ядра наружу), до тех пор, пока все электроны не найдут свое место. Химические свойства определяются уровнем заполнения самой внешней оболочки. Атомы пытаются до конца заполнить свою внешнюю оболочку, захватывая электроны у соседей или используя электроны совместно с ними. Это приводит к химическим связям. У химически инертных благородных газов внешняя оболочка заполнена, поэтому им не требуется соединение с другими атомами.
Например, связь двух атомов водорода, позволяющая существовать молекуле водорода, основана на совместном использовании двух электронов обоими атомами. Это называется ковалентной химической связью, ее открыли в 1927 году немецкие физики Вальтер Гайтлер и Фриц Лондон. Ковалентная связь играет важную роль в сложных молекулах, таких, на которых основана жизнь (мы обсудим структурные элементы жизни в части IV). Причина в том, что каждый атом при этом может иметь несколько связей с другими атомами, по-разному ориентированными относительно него. К тому же ковалентная связь очень крепкая. Особенно важны атомы углерода, у которых не хватает четырех электронов во внешней оболочке. Атомы углерода заполняют свою внешнюю оболочку разными способами, которые могут давать сложные цепочки атомов с прочными связями (рис. 17.5).
Причину, по которой в каждой оболочке может находиться ограниченное число электронов, и само это максимальное число электронов в каждой оболочке определил в 1925 году швейцарский физик Вольфганг Паули (1900–1958). Еще раньше над этой проблемой работали Арнольд Зоммерфельд и Нильс Бор. Хотя причина строения оболочек еще не была известна Бору, он смог предсказать, что неизвестный элемент под номером 72 (гафний) должен химически быть похожим на цирконий (40). Вскоре, воодушевленные этим прогнозом, датский физик Дирк Костер и венгерский химик Георг фон Хевеши, в Институте Нильса Бора открыли новый элемент.
Но решил проблему электронных оболочек Паули: он сделал вывод, что число электронов в разных оболочках ограничено тем, что стали называть принципом запрета Паули: два электрона в атоме не могут быть в одинаковом квантовом состоянии.
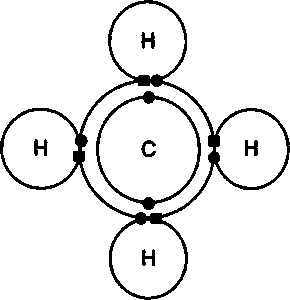
Рис. 17.5. Схема ковалентных связей в молекуле метана. Ядра показаны символами элементов С и H, а электронные оболочки — кругами. Электроны показаны темными кружочками (углерод) и темными квадратами (водород). Каждый из четырех атомов водорода делит свой электрон с углеродом для образования ковалентной связи и создания молекулы метана. Заметим, что в результате все оболочки заполнены: два электрона на внутренней оболочке и восемь электронов на внешней.
Состояния электрона описываются целыми числами, которые соответствуют орбитам электрона Бора и Зоммерфельда. Кроме того, электрон обладает спином, или состоянием вращения. На каждой орбите может быть не более двух электронов, один из которых вращается вокруг своей оси в направлении своего обращения по орбите вокруг ядра (как и большинство планет в Солнечной системе), а другой электрон — в обратном направлении. Вращение электрона вокруг своей оси нельзя понимать буквально; это лишь способ описать два спиновых состояния. Явлению атомных уровней нет точного аналога в нашей повседневной жизни.
Принципом запрета Паули определяется структура электронного облака вокруг атомного ядра и различие в химических свойствах элементов. Он также превращает атомы в твердые сферы, которые не могут легко проникнуть друг в друга, несмотря на то что про атом, следуя модели Бора, можно сказать, что в основном он состоит из пустоты.
Здравый смысл и реальность.
Квантовая физика оказалась очень точной в объяснении свойств материи, и в этом смысле она «правильная». Однако концептуальные основы квантовой теории все еще обсуждаются и изучаются. Явления микромира настолько отличаются от тех, к которым мы привыкли в макроскопическом мире, и от «здравого смысла», что нас изумляет то, как более глубокий слой действительности отражен в квантовой физике. Одним из наиболее влиятельных мыслителей в области философских аспектов квантовой механики был Нильс Бор.




