ПРИНЦИП ЗАПРЕТА ПАУЛИ И ОРГАНИЗАЦИЯ ЭЛЕКТРОНОВ ПО ОРБИТАЛЯМ
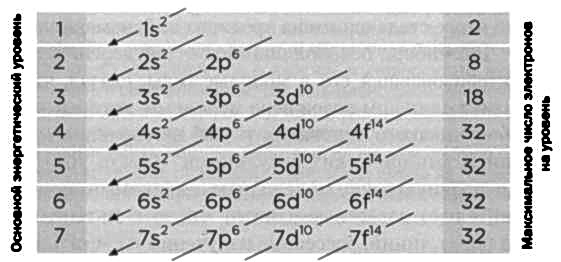
Представим себе атом с большим числом электронов. Как они распределяются вокруг ядра? Если отказаться от понятия орбиты, траектории электронов нарисовать уже нельзя, но, следуя постулатам новой квантовой механики, можно назначить им квантовые числа. Числа, косвенно отражающие уровни энергии. Любая физическая система стремится к состоянию наименьшей энергии. Если бы это было так, все электроны в стабильном атоме стремились бы к одному и тому же уровню, самому низкому. Принцип Паули запрещает именно это: не может быть двух электронов с одинаковыми квантовыми числами. Так электроны постепенно заполнят различные уровни (орбитали), начиная с самой низкой энергии. По этому правилу, орбитальная структура следует порядку стрелок на прилагаемом рисунке. Целые числа 1, 2, 3... представляют первое квантовое число, которое Бор ввел в 1913 году. Буквы s, р, d, f... представляют, в свою очередь, два квантовых числа, которые ввел Зоммерфельд: s изначально соответствовало круговой орбите; р — трем орбитам с одним и тем же эксцентриситетом, но с различными прецессиями; d — пяти орбитам, f— семи. Наконец, благодаря спиновому квантовому числу на каждой из этих орбиталей может быть по два электрона, один с положительным спином, а другой с отрицательным. Например, в случае с атомом меди, содержащим 29 электронов, его электронная конфигурация будет следующей:
1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d9.
Если сложить верхние индексы, мы увидим, что общее число электронов в сумме дает 29.
Единственная проблема, с которой столкнулся Паули, состояла в необходимости введения четвертого квантового числа, которое полностью объясняло эффект Зеемана, как нормальный, так и аномальный. Паули никак не истолковал это число, но двое молодых исследователей из Лейдена, Джордж Уленбек (1900-1988) и Сэмюэл Гаудсмит (1902-1978), решили, что это четвертое квантовое число можно считать четвертой степенью свободы электрона, чем-то вроде внутреннего вращения, аналогичного вращательному движению планет вокруг своей оси. По данной причине это четвертое атомное число было названо спином (от английского spin — «вращаться»).
Все вышесказанное подводит нас к принципу запрета Паули: в одной и той же системе, в одном и том же атоме каждый электрон должен отличаться от всех остальных; его четыре квантовых числа не могут совпадать. Это объясняет, например, что в самом низком состоянии энергии любого атома все электроны не могут находиться на первом орбитальном уровне, они распределяются по возрастающим уровням энергии и квантовым числам.
Гейзенберг развил этот новый ход мысли до конца. Речь не только о том, чтобы забыть об орбитах электронов в атомах, но и о том, чтобы перестать думать о траекториях в целом и даже о классическом понятии частицы как чего-то ограниченного в пространстве. Значительная часть новой механики была сформулирована Гейзенбергом во время отпуска на Гельголанде, маленьком острове в Северном море. Его формулировка в итоге стала одним из предложений, изменивших физику.
Гейзенберг, освободившийся от неуверенности в себе, характеризовавшей его в молодые годы, сказал, что квантовая физика слишком осложнена моделями, которые не имеют под собой никакого основания и уже не справляются с предсказанием эмпирических результатов. Вместо того чтобы брать за отправную точку модели, нам незнакомые, лучше взять действительно известные данные: число и интенсивность спектральных линий, рассеяние излучений и света или любое другое явление, связанное с электронами и излучениями. И Гейзенберг, будто нумеролог или каббалист, принялся организовывать данные энергии и интенсивности по рядам и столбцам. Так он заметил, что складываются любопытные повторяющиеся математические отношения, которые позволяют ему с относительной легкостью оперировать эмпирическими данными.
БЛЕСТЯЩИЕ И НЕЗАКОМПЛЕКСОВАННЫЕ ЮНОШИ
Историки науки много раз задавались вопросом, как возможно, чтобы поколение молодых ученых, происходивших в основном из Германии и Австрии, сумело изменить облик физики за такой короткий срок. Необходимость объяснить абсолютно новые явления, возникшая после открытия рентгеновских лучей, радиоактивности и электрона,— недостаточный аргумент. В странах, проигравших Первую мировую войну, было очень неспокойно. Гиперинфляция в Германии и, в меньшей степени, в Австрии, наряду с постоянными революционными движениями со всех сторон политического спектра, определили атмосферу неуверенности, где понятие «вероятности» накладывалось на понятие «причинной обусловленности». Молодые ученые видели необходимость разрыва со старой традицией, которая привела их страны к катастрофе. Есть и еще один аспект. В обстановке кризиса и неуверенности, если кто-то хотел получить должность в университете, нужно было уметь привлечь к себе внимание. Так социально-экономическая обстановка определила рискованный ход мысли для молодежи, озабоченной своим профессиональным будущим. Естественно, мы говорим только о тех революционных идеях, которые работали, иначе можно было бы вспомнить множество теорий, отошедших в мир иной; имена их создателей так и не попали в историю науки. Несомненно одно: в более стабильной, более традиционной ситуации идеи таких людей, как Гейзенберг и Паули, принять было бы сложнее.

Вернер Гейзенберг.
Первым, с кем он обменялся идеями, был Паули, и только на исходе лета взволнованный Бор увидел, что спустя десять лет его радикальная идея уже устарела, а молодые ученые вроде Гейзенберга и Паули меняют облик физики. По достоинству оценил проделанную Гейзенбергом работу его старый учитель и коллега по Геттингену Макс Борн, в большей степени математик, чем физик. Он увидел, что числовые отношения, найденные Гейзенбергом, совпадают с алгеброй Давида Гильберта (1862-1943), выведенной за несколько лет до этого также в Гёттингене. То есть идеальная конструкция (гильбертовы пространства), сформулированная для развития чистой математики, нашла практическое применение в объяснении физики самого малого и невообразимого.
Как толковал свою новую теорию сам Гейзенберг? Что означало забыть об орбитах и траекториях и сосредоточиться на наблюдаемых энергиях и амплитудах? Сотрудничество Бора и Гейзенберга достигло одной из кульминационных точек, которой стало появление так называемого «принципа неопределенности Гейзенберга». Он утверждает, что невозможно измерить одновременно и точно скорость и положение определенной частицы (то же самое справедливо для любой пары «сопряженных» величин, таких как энергия и время). Невозможность эта не просто техническая: она свойственна самому процессу измерения в атомном масштабе, поскольку само измерение предполагает значительное воздействие на измеряемое.




