А кроме этого его супруга — просто прелесть.
Эрих Регенер о Шрёдингере, своем коллеге в Штутгарте
В Штутгарте Шрёдингер погрузился в чтение монографии Арнольда Зоммерфельда «Строение атома и спектры», ставшей классикой еще до того, как на издании высохла типографская краска. Шрёдингер заинтересовался этой темой и, как это уже было с общей теорией относительности, почти сразу опубликовал статью с уточнениями атомной модели Зоммерфельда. В Бреслау ученый задержался всего на несколько недель: еще в Штутгарте он получил приглашение возглавить кафедру теоретической физики Цюрихского университета. На этом посту он стал преемником Альберта Эйнштейна и Макса фон Лауэ — и был согласен на более скромное жалованье.
Должность профессора в одном из самых престижных университетов Европы стала для Шрёдингера трамплином в его академической карьере. Кажется, сам воздух города был особым — то ли из-за горных альпийских ветров, то ли из-за дыхания Цюрихского озера. Атмосфера здесь стимулировала воображение не только революционеров, таких как Ленин или Троцкий, или писателей, таких как Джойс. Именно в Цюрихе была завершена теория относительности Эйнштейна, здесь работали фон Лауэ и Петер Дебай.
Ранее Шрёдингер демонстрировал исключительную универсальность, исправляя и углубляя работы других ученых в большинстве дисциплин, вызывавших его интерес. Но этот широкий диапазон, казалось, подтверждал известную пословицу о двух зайцах: ни в одной из этих дисциплин сам Шрёдингер не создал ничего революционного. Комиссия в Цюрихе попросила венского физика Зоммерфельда охарактеризовать своего молодого коллегу, и тот отметил: «Первоклассный ум, очень твердый и критический». И чаша весов склонилась на сторону Шрёдингера — диапазон его возможностей, казалось, удовлетворил всех. Приемная комиссия особенно оценила исследования ученого о восприятии цвета, потому что его назначение позволяло «проводить конференции по биометрии, так любимой биологами».
Ученый появился в Цюрихе в середине октября 1921 года, измученный трауром и многомесячными переездами. «Я был настолько истощен, — признавался он, — что у меня уже не оставалось никаких идей». Из-за усталости вновь дали о себе знать слабые легкие, и Шрёдингер, едва заняв новую должность в университете, вынужден был просить отпуск, чтобы отправиться на лечение и отдых на альпийский курорт Ароза. Он вернулся к работе через полгода, в ноябре 1922-го. За весь следующий год физик не опубликовал ни одной статьи. Учитывая, что ему было уже 36 лет — возраст, в котором творческая энергия многих ученых уже иссякает, — можно было посчитать, что научная карьера Шрёдингера завершена.
Музыка атомов
В твердых телах и жидкостях свобода атомов ограничена, поскольку их движения сдерживаются электромагнитным взаимодействием, создающим между ними прочную связь. Это взаимное влияние, соединяющее миллиарды ядер и электронов, вводит определенную сложность, отсутствующую в газе, молекулы которого часто можно рассматривать как практически независимые. Вещество твердых тел и жидкостей не только взаимодействует с окружающим миром, но и поддерживает тесные связи внутри самого себя. Изучение газов помогает понять диалог, который свет ведет с каждым атомом.
Чтобы сделать этот диалог видимым, газ может быть нагрет или подвергнут воздействию электрического поля, — опыт, распространенный в лабораториях XIX века. Одним из наиболее популярных приборов в то время была газоразрядная лампа: стеклянная колба с двумя электродами, между которыми создается разность потенциалов. Внутри лампы находится газ — водород, гелий, криптон или пары ртути и натрия.
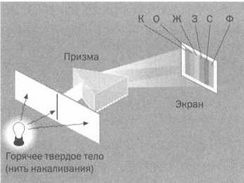
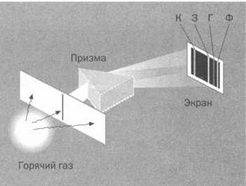
Разница между непрерывным спектром твердого тела и дискретным спектром газа.
В первом случае перед нами непрерывный диапазон цветов от красного до фиолетового. Во втором мы видим полосы изолированных цветов.
К: красный О: оранжевый Ж: желтый 3: зеленый Г: голубой Ф: фиолетовый
При превышении порогового напряжения лампа испускает интенсивное свечение. Если пропустить ее свет через призму, можно наблюдать последовательность тонких линий различных цветов, разделенных полосами черного цвета. Спектр газов, таким образом, гораздо проще спектра излучения твердых тел или жидкостей (непрерывного вдоль широкого диапазона частот). Если воспользоваться аналогией из предыдущей главы, это соответстует такому распределению, когда вес концентрируется вокруг нескольких дискретных значений (см. рисунок выше).
Спектроскописты поняли, что разность потенциалов влечет испускание из катода (отрицательного электрода) потока электронов, которые пересекают лампу в направлении анода (положительного электрода). Если на своем пути эти электроны сталкиваются с молекулами газа, это порождает световое излучение, которое ученые проанализировали с помощью призмы. Каким образом работает прибор, было неизвестно. Единственное, чем располагали физики, — это набор светящихся линий, наблюдаемых в спектре каждого газа. Как показано на рисунке, для водорода при очень низком давлении видимы четыре линии, соответствующие цветам с длинами волн 410 нм (фиолетовый), 434 нм (голубой), 486 нм (зеленый) и 656 нм (красный). Почему именно эти длины волн? Почему для каждого элемента эти волны разные? Все это было тайной.
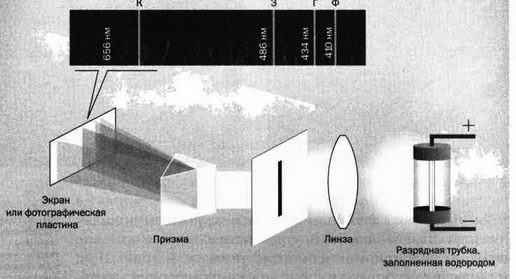
Экспериментальная установка для определения видимого спектра водорода. Г азоразрядная трубка содержит водород в газообразном состоянии и начинает светиться, как только разность потенциалов превышает заданный порог. Линза и прорезь собирают и направляют часть света, передаваемого на призму, которая раскладывает луч на цвета.
В 1885 году Иоганн Якоб Бальмер, швейцарский математик, зарабатывавший на жизнь преподаванием в женском институте Базеля, проанализировал эту проблему. Он не искал решение в лаборатории, а довольствовался изучением данных, опубликованных физиками-экспериментаторами. Внимание ученого привлекла головоломка с водородом. В 60 лет он оказался способен найти модель, которая бросала вызов воображению физиков. Она выглядела так:
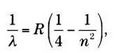
где n является целым числом (3, 21, 102 и так далее) при n> 2 и где R — постоянная Ридберга со значением R = 1,097 х 107 м-1. При введении в это уравнение п = 3, 4, 5 и 6 λ водорода, кажется, появляется из ниоткуда: 656 нм, 486 нм, 434 нм и 410 нм.

