Электроны, перепрыгивающие с нескольких более высоких уровней на один и тот же более низкий уровень энергии, приводят к образованию четырех спектральных линий серии Бальмера. Размер излучаемого кванта энергии зависит только от начального и конечного состояния. Именно из-за этого формула Бальмера дает возможность правильно рассчитать длины волн серии спектральных линий, если положить n = 2 и считать, что т поочередно принимает значения 3, 4, 5 или 6. Формула Бальмера позволила Бору рассчитать и другие спектральные серии, которые получаются, если зафиксировать самый низкий энергетический уровень, на который может прыгнуть электрон. Например, если перескоки электрона заканчиваются уровнем n = 3 получается серия Пашена из инфракрасной области спектра, а перескоки, заканчивающиеся на уровне n = 1, генерируют так называемую серию Лаймана в ультрафиолетовой области23.
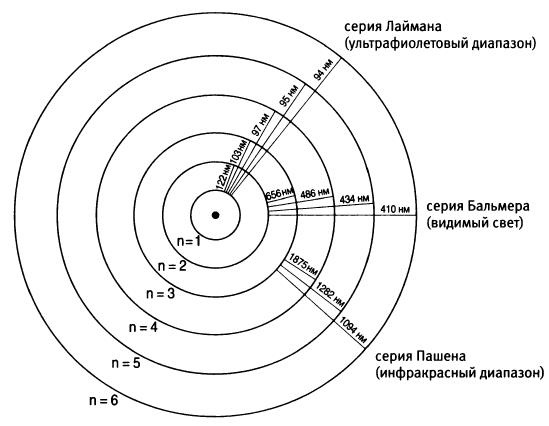
Рис. 7. Энергетические уровни, спектральные линии и квантовые прыжки (рисунок не в масштабе)
Бор обнаружил странную особенность, связанную с квантовыми скачками. Невозможно определить, где во время прыжка находится электрон. Переход между орбитами, энергетическими уровнями, должен происходить мгновенно. Иначе все время перехода с орбиты на орбиту электрон будет излучать энергию. В атоме Бора электрон не может оказаться между орбитами. Как по волшебству он исчезает с одной орбиты и возникает на другой.
“Я абсолютно уверен, что проблема спектральных линий неразрывно связана с вопросом о природе кванта”. Удивительно, но это слова из дневника Планка24. Запись сделана в феврале 1908 года. До появления атома Резерфорда это было все, на что мог решиться Планк, продолжавший борьбу за минимизацию влияния кванта. Бор использовал идею о том, что электромагнитное излучение испускается и поглощается квантами. Но в 1913 году и он еще не мог согласиться с тем, что квантовано само электромагнитное излучение. Даже в 1919 году, когда Планк в своей Нобелевской лекции заявил, что квантовый атом Бора — это “долгожданный ключ, который поможет открыть дверь в удивительную страну” под названием спектроскопия, еще мало кто верил в кванты света Эйнштейна25.
Шестого марта 1913 года Бор отправил Резерфорду первую из трех статей и попросил передать ее в редакцию “Философикал мэгэзин”. В то время (да и еще много лет спустя), чтобы статья молодого ученого была быстро напечатана в английском журнале, ее должен был представить маститый ученый вроде Резерфорда. “Мне не терпится узнать, что вы обо всем этом думаете”, — написал Бор Резерфорду26. Особенно Бора заботила реакция на смешивание квантов с классической физикой. Ответ Резерфорда не заставил себя долго ждать: “Вы проявили большую находчивость в вопросе, касающемся происхождения спектра водорода. Похоже, ваш подход удачен. Но смесь идей Планка со старой механикой очень затрудняет возможность понять, что с точки зрения физики за всем этим кроется”27.
Резерфорду, как и многим другим, трудно было себе представить, как электрон в атоме водорода “прыгает” с одного энергетического уровня на другой. Сложность состояла в том, что в модели Бора нарушался один из основных законов классической физики. Двигающийся по кругу электрон представляет собой колебательную систему: один полный оборот по замкнутой орбите есть осцилляция, а число оборотов за одну секунду — частота осцилляций. Осциллирующая система излучает энергию на частоте, равной частоте осцилляций. Но поскольку в “квантовом прыжке” электрона участвуют два энергетических уровня, мы имеем дело с двумя частотами осцилляций. Резерфорд сокрушался о том, что в теории нет связи между этими частотами, между “старой” механикой и частотой излучения при прыжке электрона с одного энергетического уровня на другой.
Резерфорд указал на еще одну, даже более серьезную, проблему: “Мне кажется, у Вашей гипотезы есть еще одно очень слабое место. Я не сомневаюсь, что Вы и сами это полностью осознаете. Как электрон решает, с какой частотой он будет колебаться, переходя из одного стационарного состояния в другое? Мне кажется, Вы должны были предположить, что электрон заранее знает, где ему надо остановиться”28. Электрон с энергетического уровня п = 3 может перепрыгнуть либо на уровень п = 2, либо на уровень п = 1. Кажется, что электрону, совершающему прыжок, чтобы испустить излучение нужной частоты, надо “знать”, на какой энергетический уровень он направляется. Эти пробелы в теории квантового атома Бор объяснить не мог.
Было еще одно, более мелкое замечание, напугавшее Бора гораздо сильнее. Резерфорд полагал, что “статью следует сократить”, поскольку “длинные статьи отпугивают читателей, которые считают, что у них нет времени вдаваться во все эти подробности”29. Резерфорд предложил исправить английский текст Бора в тех местах, где это необходимо, а в постскриптуме добавил: “Надеюсь, Вы не будете возражать, если я по собственному усмотрению выброшу из статьи то, что мне не представляется необходимым? Жду ответа”30.
Получив письмо, Бор пришел в ужас. Мучительно подбиравшему слова, написавшему множество черновиков, многократно переписавшему статью датчанину мысль о том, что кто-либо (даже сам Резерфорд!) будет менять его текст, казалась кощунственной. Через две недели Бор послал дополненный и переработанный текст. Резерфорд согласился, что изменения “очень хороши и представляются вполне уместными”, однако вновь посоветовал сократить статью. Еще до того, как Бор получил это последнее письмо, он написал Резерфорду, что собирается приехать в Манчестер на каникулы31.
Когда Бор появился у Резерфордов, у них в гостях был их друг Артур Ив. Потом он вспоминал, что Резерфорд сразу провел “худощавого паренька” к себе в кабинет, а миссис Резерфорд ему объяснила, что муж “очень высоко оценивает работу этого молодого датчанина”32. Обсуждение статьи продолжалось несколько вечеров. Потом Бор признался, что когда он пытался защищать каждое слово, Резерфорд “проявлял почти ангельское терпение”33.
Наконец Резерфорд сдался. Потом он убеждал своих коллег и друзей, что в статье ничего трогать было нельзя: “Я увидел, что он взвесил каждое слово. Меня поразило, как твердо он отстаивал каждую фразу, каждое выражение, каждую цитату. Все было на своих местах. Хотя сначала мне и казалось, что многие предложения можно опустить, после его объяснений стало ясно, как точно все было подогнано. Ничего нельзя было менять”34. Много позднее Бор признал, что Резерфорд был прав, “возражая против усложненной публикации”35.
Три статьи Бора под общим названием “О строении атомов и молекул” вышли в журнале “Философикал мэгэзин”. Первая, датированная 5 апреля 1913 года, увидела свет в июле. Вторая и третья были опубликованы в сентябре и ноябре. Они касались идей, связанных с возможным расположением электронов внутри атомов. Этот вопрос занимал Бора еще десять лет. С помощью квантового атома он пытался объяснить периодическую таблицу и химические свойства элементов.



