Современная молекулярная диагностика все это умеет: и выделить ДНК плода из крови матери (теперь даже биопсия не нужна!), и прочитать ее определенный участок. Но в 1983 г. это казалось абсолютной утопией. Не так просто было даже получить нужный фрагмент ДНК – то есть были способы, но Кэри Муллис хотел придумать что-то побыстрее и подешевле.
Дано: мы можем синтезировать любой олигонуклеотид. Можем мы синтезировать нуклеотид, комплементарный участку рядом с мутацией, в наличии или отсутствии которой мы хотим убедиться? Нет проблем. А можем мы добавить к ДНК, которую хотим проанализировать, такой олигонуклеотид и ДНК-полимеразу, чтобы та наращивала цепочку ДНК, начиная от олигонуклеотида, совсем как в секвенировании по Сенгеру? (В такой реакции олигонуклеотид называется праймером, или затравкой, потому что с него начинается синтез ДНК.) Только пусть праймер будет вплотную к сайту (точке) мутации, а в смеси будут дидезоксинуклеотидтрифосфаты с радиоактивной меткой – те, которые у Сенгера останавливают синтез цепочки. Это будет как секвенирование одного нуклеотида. (И в самом деле, немного похоже на один цикл некоторых современных методов секвенирования!)
Теоретически мы все это можем. Практически – будут проблемы: на относительно коротком фрагменте ДНК, в несколько тысяч нуклеотидов, это сработало бы, но геном человека длинен, нужный участок короток, его концентрация исчезающе мала, к тому же есть ненулевая вероятность, что в нашем огромном геноме присутствуют другие похожие участки, с которыми может гибридизоваться олигонуклеотид. (Вспомним саузерн-блоттинги Алека Джеффриса: подобрать зонд, который не метил бы в ДНК все подряд, – непростая задача.) И как тогда отличить интересующий нас сигнал от ложного? Жизнь вечно портит самые прекрасные идеи. Ладно, пропустим это и будем думать дальше, как будто проблемы нет.
Но раз олигонуклеотидов у нас много, почему бы не сделать два олигонуклеотида, комплементарные обеим цепям ДНК, по обе стороны от сайта мутации? (Читатели не забыли, что нити ДНК имеют направление, от 5’ – к 3’ – концу, и только в этом направлении полимераза может наращивать цепь? Два таких олигонуклеотида “указывали” бы на возможную мутацию с двух сторон.) И пусть к одному олигу полимераза присоединит дидезоксинуклеотид А, а к другому – дидезоксинуклеотид Т, и мы точно убедимся, что А не заменен на G… не слишком красивая идея, зато простая и осуществимая.
Что может пойти не так? Ну, прежде всего, в образце могут быть обыкновенные свободные нуклеотиды, и ДНК-полимераза, конечно, будет присоединять их, тогда прощай радиоактивный фрагмент определенной длины. Но можно перед анализом обработать образец ферментом – бактериальной щелочной фосфатазой, которая отъест все фосфатные группы от нуклеотидов, и тогда полимеразе не с чем будет работать, кроме тех меченых нуклеотидов, которые добавим мы. Только как ее потом убрать, чтобы она добавленные нуклеотиды не съела? В то время считалось, что щелочную фосфатазу невозможно инактивировать нагреванием, якобы потом она восстанавливает активность (на самом деле инактивировать ее возможно, если не добавлять в раствор цинк, отмечал позднее Кэри Муллис, но хорошо, что я тогда об этом не знал…).
Думаем дальше: а что можно сделать, если не избавляться от обычных нуклеотидов? Пусть полимераза их использует, разрешаем. Пусть она нарастит такие длинные цепочки, какие сможет. А потом слегка нагреем раствор, чтобы двойные цепочки ДНК расплавились и разошлись, и охладим, чтобы к однонитевой ДНК присоединились новые праймеры. Олигов, как мы помним, у нас много, добавим в смесь, сколько не жалко…
Но позвольте, ведь теперь, кроме ДНК образца, у нас появились еще две нити, синтезированные в первой реакции, и каждая из них тоже содержит участок, комплементарный противоположно направленному праймеру. Четыре цепочки ДНК вместо двух изначальных… Стоп! Но это же как раз то самое, что нам было нужно: увеличение концентрации интересующего нас участка ДНК, чтобы он стал заметнее на фоне всей остальной ДНК, которая нас сейчас не интересует.
А если сделать это специально?
А если сделать это не один раз, а два, три, четыре, пять, шесть? И в каждом цикле число нитей ДНК будет удваиваться, как в той сказке про царя, изобретателя шахмат и рисовые зерна на шахматной доске…
Кэри остановил машину, нашел в бардачке ручку и бумагу и начал считать. Если, скажем, раз 30 повторить этот цикл – “добавить к образцу полимеразу, нуклеотиды и праймеры – провести реакцию – расплавить ДНК – провести реакцию” – то образец будет содержать множество копий интересующего нас фрагмента ДНК, а все остальное, ненужное и путающее, станет на его фоне малозначащей примесью.
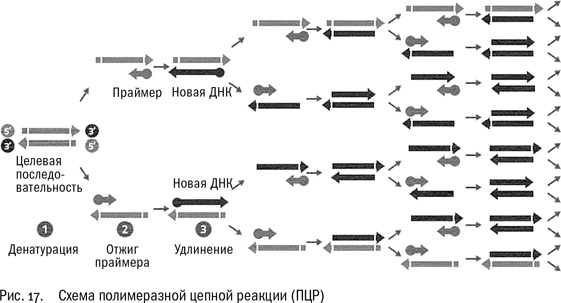
Дженнифер проснулась и спросила, почему они не едут. Кэри снова тронулся в путь и примерно через милю сообразил, что праймеры необязательно должны быть разделены всего одним нуклеотидом. Черт с ними, с точечными мутациями – таким способом можно получить в достаточном количестве любой фрагмент ДНК!
До изобретения Кэри Муллиса эти фрагменты получали в основном клонированием. Слово “клонирование” вообще означает получение множества копий одного объекта. Клонирование животных – получение генетически идентичных копий особи из ее соматических, то есть неполовых клеток. Клонирование человека – популярный фантастический сюжет, с приматами дело пока не очень ладится (лишь в начале 2018 г., через 22 года после овцы Долли, китайцы опубликовали статью о клонировании детенышей макаки). Клонирование растений широко известно под названием “черенкование”. Клонирование клеток, например лимфоцитов, вырабатывающих антитела, – размножение клеток определенного типа.
Клонированием ДНК называли довольно сложную процедуру – включение нужного фрагмента в кольцевую ДНК (плазмиду), внедрение этой ДНК в кишечную палочку E.coli и выращивание этих кишечных палочек, сначала на чашке Петри, потом в колбе с питательной средой. Бактерии размножаются, копируют плазмиду и вместе с ней наш кусок ДНК; потом плазмиду можно будет выделить, вырезать нужный кусок рестриктазой и отделить его от других с помощью электрофореза. Дело долгое, к тому же культура кишечной палочки пахнет замоченным и протухшим бельем (точнее, наоборот, таз с бельем у нерадивой хозяйки имеет запах этой бактерии). Но ДНК нужна для работы, да и запах привычного человека радует: если так пахнет, значит, культура не загрязнена посторонними микроорганизмами.
Что представляло собой клонирование ДНК на тот момент, когда Кэри Муллис вез Дженнифер в горы? Ну, например, как-то так. Интересующую нас ДНК нарезаем рестриктазой на куски по несколько тысяч пар нуклеотидов. Затем фрагменты вставляем в плазмиду, или вектор, – колечко ДНК, предварительно разрезанное той же рестриктазой. Плазмиды бактерий – дополнительные, внехромосомные генетические элементы, которыми они могут обмениваться или поглощать их из внешней среды. Плазмида может содержать некие дополнительные гены, полезные в определенных условиях, например гены устойчивости к антибиотику. Внедрение вектора в бактерии называется трансформацией – это, по сути, тот самый процесс, который использовали для доказательства роли ДНК как наследственного материала Эвери с коллегами в первой главе, помните?



