Однако при этом, в отличие от травматического или инфекционного повреждения клеток, когда все клеточное содержимое просто «вываливается» во внеклеточную среду и вызывает активную воспалительную реакцию, нормальный апоптоз протекает очень аккуратно. Расщепление клеточных белков и аминокислот не нарушает целостности липидной мембраны. В конце концов, «наплясавшись», клеточный бульон оказывается аккуратно упакован в так называемые апоптотические тельца и быстро «подъедается» клетками иммунной системы по принципу «не пропадать же добру». А освободившееся место вскоре занимает новая, свежеотделившаяся клетка.
Апоптоз не единственная форма регулируемой клеточной гибели, известная на сегодняшний день. Кроме него, существуют еще аутофагия, некроз, ферроптоз… В настоящее время ученые насчитывают больше десятка путей, приводящих клетку к смерти. Их роль в нормальных и патологических процессах в человеческом организме активно изучается биологами.
 ФАКТ: механизмы регулируемой гибели клеток, самым известным из которых является апоптоз, — такая же неотъемлемая часть нашей биологической природы, как механизмы клеточного деления.
ФАКТ: механизмы регулируемой гибели клеток, самым известным из которых является апоптоз, — такая же неотъемлемая часть нашей биологической природы, как механизмы клеточного деления.
«Звездная молекула» онкологии — Р53
В главе, посвященной клеточному делению, несколько раз упоминались «контрольные точки клеточного цикла», в которых клетка проверяет качество копирования генома и наличие ошибок в нем. Если ошибок слишком много, клеточный цикл останавливается и клетка направляется на путь запрограммированной клеточной гибели. Так, в норме, предотвращается размножение мутировавших клеток и поддерживается генетическая однородность организма. При раке этот важнейший механизм, как правило, оказывается нарушен, что позволяет раковой клетке «закрывать глаза» даже на существенные перестройки генома и продолжать делиться, из поколения в поколение накапливая мутации.
Во многих случаях этот эффект связан с повреждением одного-единственного белка р53, который по праву может быть назван «звездой» молекулярной онкологии по числу посвященных ему исследований и публикаций. Именно этот белок соединяет в целое системы регуляции стабильности генома и апоптоза. Его почетное имя наводит на мысль о супергероях из вселенной «Марвел». Р53 — это «страж генома», что звучит почти так же эффектно, как «страж галактики».
Существует известный анекдот про мальчика, который до пяти лет молчал, и поэтому все были уверены, что он немой, а потом вдруг сказал: «Каша подгорела!» А на вопрос пораженных родителей: «Что же ты раньше ничего не говорил?» — ответил: «Раньше все было нормально». Р53 похож на этого смышленого малыша. В нормальной здоровой клетке этот белок находится в связанном (неактивном) состоянии с белком МDM2, то есть «безмолвствует». Однако стоит организму подвергнуться какому-то вредному воздействию, например ультрафиолетовому облучению, вызывающему нарушение в ДНК, как комплекс МDM2/р53 распадается и «страж генома» принимается за работу. При этом надо отметить, что такая реакция происходит при самых разных типах клеточного стресса, от радиоактивного до гипоксического (вызванного дефицитом кислорода), обеспечивая универсальный клеточный ответ «на все случаи жизни».
Первоначальное повышение уровня свободного р53 запускает механизмы репарации ДНК, которые должны исправить ошибки в геноме, и, если это удается, высвобождение белка прекращается, его уровень стремительно понижается, и жизнь клетки возвращается в обычное русло. Однако, если нарушения зашли слишком далеко, концентрация р53 в клетке продолжает нарастать, и он запускает программу апоптоза. Таким образом, будущее клетки, оказавшейся в «контрольной точке», — продолжит она клеточный цикл или погибнет — во многом зависит от этого единственного белка.
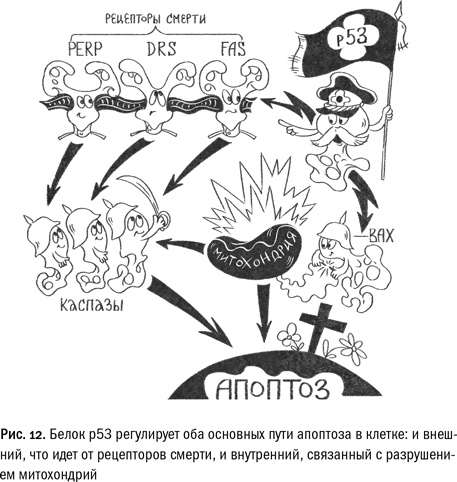
Существует два основных пути запуска апоптоза: изнутри клетки (через разрушение митохондрий) и извне (через активацию так называемых рецепторов смерти). Р53 регулирует их оба. Этот белок является транскрипционным фактором, а значит, он может связываться с ДНК и регулировать активность разных генов. В клетках человека р53 одновременно запускает и синтез одного из рецепторов смерти FAS, и производство белка Bax, который, встраиваясь в мембрану митохондрий, разрушает эти органеллы.
В случае мутации в гене р53 функция соответствующего белка нарушается. По статистике от 50 до 70 % злокачественных опухолей имеют одну или несколько мутаций в гене р53 и как результат — нарушенную регуляцию апоптоза. Может быть, вот она — универсальная молекула, приручив которую можно победить рак? Может быть, двух копий гена р53, которые присутствуют в нашем организме, просто маловато, чтобы эффективно противостоять болезни, а будь их, например, четыре и веди они себя более активно, проблема была бы решена? Ученые решили проверить это предположение и сконструировали генетически модифицированную мышь с повышенной активностью гена р53. Эти животные по сравнению со своими «дикими» собратьями действительно демонстрировали поразительную устойчивость к образованию злокачественных опухолей. Но одновременно, увы, у них обнаружились все признаки преждевременного старения — сосудистые нарушения, уменьшение массы тела и т. д. В общем, как это довольно часто бывает в биологии, выяснилось, что слишком много хорошего — тоже плохо.
При этом известно, что у слонов — которые, несмотря на свои огромные размеры и продолжительность жизни, сопоставимую с человеческой, очень редко болеют раком — количество гена р53 увеличено. Геномный анализ показал, что у африканских слонов есть целых 40 копий гена p53, у азиатских — от 30 до 40. Так что вопрос о том, с кем мы, люди, — с мышами или со слонами, все еще остается открытым.
Пока же ученые ищут способы восстановления нормальной активности р53 в злокачественных клетках. Это непростая задача, потому что для ее решения необходимо обеспечить не только доставку терапевтического агента в опухоль, но и его проникновение сквозь цитоплазматическую мембрану внутрь клеток. (Проблема целевой доставки лекарственных средств в определенный орган или определенную группу клеток вообще является «узким местом» современной фармакологии, которая, как правило, «бьет по площадям», воздействуя на весь организм.)
Для того чтобы усилить активность р53 в раковых клетках, используются как методы генной терапии (когда нормальный р53 доставляется в опухоль в аденовирусном векторе), так и поиск молекул, способных скомпенсировать дефект мутантного белка. Речь идет о своего рода «молекулярных костылях», которые позволят белку р53 нормально функционировать в клетке несмотря на мутации, нарушающие его структуру. Результаты этих исследований пока еще не вышли на стадию клинических испытаний, но направление выглядит многообещающим.

