И на этом месте наше руководство, к сожалению, заканчивается.
В нем вы нашли ответы на многие вопросы, имеющие глубокую жизненную ценность, включая «Из какой такой фигни сделана вселенная?» (раздел 11), «Как мне жить в комфорте и не умереть некоторое время?» (раздел 5) и «Меня терзает понос, и я хотел бы как-то справиться с ним, так что, может, кто-то в курсе, что вообще нужно делать?» (раздел 14). Мы совершенно уверены, что знания послужат вам хорошо в те дни, месяцы и годы, что лежат у вас впереди.
По поводу того, что вы вышли из произведения искусства в виде машины времени FC3000тм (рис. 72) и увидели девственную Землю – которая скоро будет превращена в дом, общество и в цивилизацию, – мы вам завидуем. Вы готовитесь войти в мир неописуемых чудес и огромного потенциала, и вы встречаетесь с ним, имея то, чего не было у остального человечества: дар предвидения. Используйте его мудро, и вы достигнете высот, о которых мы никогда и не мечтали, да еще и избежите позорных и ужасных падений, имеющихся в нашей истории.
Чтение этой книги позволило перенести знание о великих достижениях человечества с вашей ладони в глубины вашего же мозга. Ранее мы отмечали, что этот текст, оказавшись в прошлом, стал уникальной, могущественной и самой опасной вещью на планете.
Теперь это неправда… такой вещью стали вы.
Так что иди и возьми их, тигр!

Рис. 72. Несмотря ни на что, машина времени FC3000тм
С самыми теплыми профессиональными пожеланиями от ваших друзей из «Хронотикс Солюшн».
Приложение А
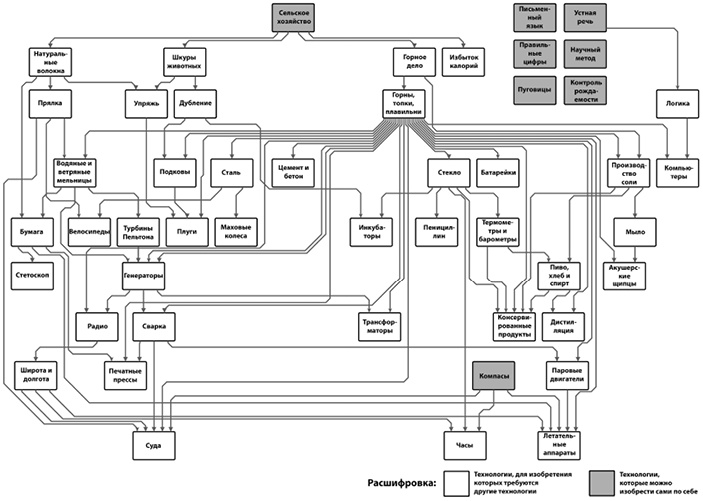
Дерево технологий
Приложение В
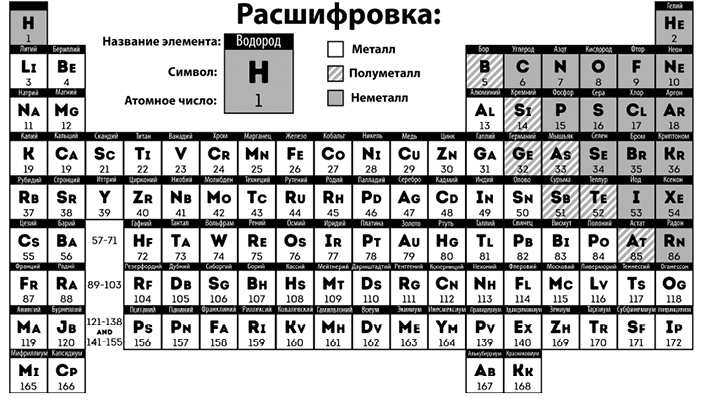
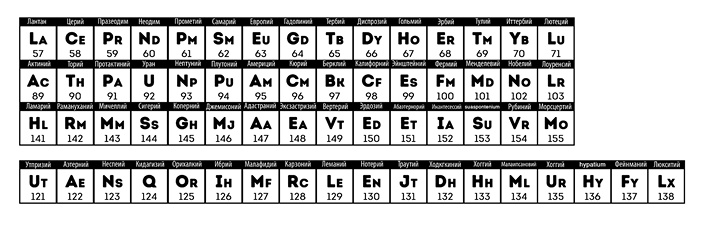
Периодическая таблица элементов
Приложение С
Полезные химикаты, как их изготавливать, и как они могут убить вас
В этот раздел включены инструкции по изготовлению всех химических веществ, которые необходимы для использования руководства, а также и других субстанций, что требуются для восстановления цивилизации. Сначала приведен список необходимых соединений, и изложение организовано так, что вы узнаете все в нужном порядке.
Однако перед тем как вы воодушевленно начнете производить химикалии с бухты-барахты, учтите, что есть причина тому, что каждое из описаний соединений имеет подраздел, озаглавленный «Как это может определенно убить вас». Причина заключается в том, что все это чертовски опасные хреновины, которые могут убить вас по глупой случайности. Будьте осторожны и не изготавливайте ничего подобного, если вы не заперты в прошлом и страшно не нуждаетесь в разной полезной химии.
С1. Аммиак
Формула: NH3.
Внешний вид: бесцветный газ.
Впервые получен: 1774 н. э.
Описание: чрезвычайно полезное соединение, использовалось нашей цивилизацией самыми разными способами и до сих пор входит в число химикалий с наибольшими объемами производства. Аммиак – удобрение, охладитель, антисептик, а в комбинации с водой дает прекрасное чистящее средство, способное убрать потеки с любой блестящей поверхности.
Как изготовить
Аммиак – NH3 – состоит из азота и водорода, а и того и другого на Земле много. Когда мы в этом случае говорим «много», то имеем в виду именно много: азот – основной компонент атмосферы, а водород – самый распространенный элемент во всей вселенной. Однако газообразный азот – N2 – уже связан сам с собой и совершенно не горит желанием вступать в какие-либо реакции, так что весь азот, которым мы окружены, не особенно полезен.
При этом вы можете собирать природный хлорид аммония в виде соли (NH4Cl) прямо с земли. Подобная штука образуется естественным путем при участии вулканических газов, так что эти кристаллы можно найти в тех местах, где такие газы выходят из трещин. Если копаться в склонах вулканов не входит в ваши планы, вы также можете отыскать хлорид аммония в верблюжьем навозе: поскольку эти животные хорошо переносят избыток соли, то они потребляют много хлора, ну а аммиак в организм попадает всегда.
Высушите этот навоз и сожгите в замкнутом пространстве, оставьте единственный выход для копоти. Над ним расположите некий холодный материал – стекло или камень, – чтобы содержащийся в дыме хлорид аммония конденсировался на нем в виде кристаллов. Добавьте гашеной извести к хлориду аммония, нагрейте смесь, и у вас получится газообразный аммиак.
Если под рукой у вас нет ни верблюдов, ни солей аммония хлорида, то аммиак можно получить, собирая рога и копыта оленей, после чего подвергая их сухой дистилляции (см. раздел 10.1.1). Вместо хлорида аммония пепел будет содержать карбонат аммония, поэтому его нужно нагреть до 60 °C или сильнее, и карбонат аммония начнет разлагаться на диоксид углерода, аммиак и воду.
Это делает карбонат аммония удобным источником аммиака, а еще его можно использовать для разрыхления хлеба вместо кухонной соды.
Если и рогов с копытами вы не обнаружили, то аммиак можете найти в вашей собственной моче. Все млекопитающие избавляются от избытка азота через процесс мочеиспускания, и предварительно бактерии превращают азот в аммиак, чей неприятный запах властвует в туалетах, где редко убираются (надеемся, что в вашей цивилизации таковых не будет). Всего лишь нужно ферментировать обычную мочу и добыть из нее газ.
Само собой, все эти технологии неспешны и позволяют добыть сравнительно небольшие количества аммиака. Чтобы добраться до промышленного уровня, вам потребуется изобрести варочный автоклав, то есть просто металлическую кастрюлю, способную надежно закрываться.
Доведите ее до 450 °C и примерно 200 атмосфер давления, и вы заставите водород и кислород в воздухе реагировать, чтобы получился аммиак. Это куда более эффективный способ, но он несколько сложнее, чем «соберите верблюжий навоз и сожгите его».
Как это может убить вас
Человек на самом деле может удалять избыток аммиака из организма (мы выводим его с мочой, именно поэтому она может служить ресурсом), так что вы не должны особенно беспокоиться по поводу того, что поглотите слишком много этого вещества. Спите спокойно, любители аммиака. Но это едкий газ, в высокой концентрации он может разъесть ваши легкие, так что не исключено, что вам не стоит спать столь спокойно прямо сейчас.
С2. Карбонат кальция
Также известен как: мел.

