

Данное исследование было выполнено биологами из Калифорнийского университета в Сан-Франциско (США) в 2013 году (Baker et al., 2013). Работа пролила свет на процесс появления эволюционных новшеств в результате генных дупликаций — на два важных его аспекта.
Во-первых, она показала, что генные дупликации могут чисто автоматически, через ряд взаимообусловленных промежуточных шагов, приводить к усложнению регуляторных генных сетей. Это происходит даже в том случае, если в подобном усложнении нет необходимости и организм мог бы продолжать с тем же успехом обходиться простой регуляторной сетью.
Во-вторых, работа показала, что копиям удвоившегося гена (паралогам) не всегда удается легко и быстро разделить функции, особенно если ген включен в сложную сеть межмолекулярных взаимодействий. В этом случае копии, едва начав делить функции, начинают конкурировать и мешать друг другу работать. Для устранения этой проблемы требуется закрепление дополнительных мутаций, что способствует окончательному превращению паралогов в два специализированных белка со строгим разделением обязанностей.
Авторы изучили последствия дупликации гена Mcm1 у дрожжей. Этот ген есть у всех грибов. Он кодирует важный регуляторный белок, который, объединяясь в комплексы с другими регуляторными белками (кофакторами), присоединяется к ДНК, чтобы активировать близлежащие гены (рис. 18.1). Mcm1 в целом консервативен, хотя и имеет некоторые различия у разных видов.
У некоторых дрожжей, например Kluyveromyces lactis, гены метаболизма аргинина (ARG) регулируются комплексом из двух белковых молекул Mcm1 (такие комплексы называют гомодимерами), который, в свою очередь, соединяется с кофактором Arg81 (рис. 18.1, а). У пекарских дрожжей, Saccharomyces cerevisiae, и их ближайшей родни белковый комплекс, регулирующий работу генов ARG, устроен сложнее. Он включает не два, а три разных белка. Вместо гомодимера из двух молекул Mcm1 пекарские дрожжи используют гетеродимер — соединенные молекулы белков Mcm1 и Arg80 (рис. 18.1, б), и уже этот гетеродимер соединяется с Arg81.
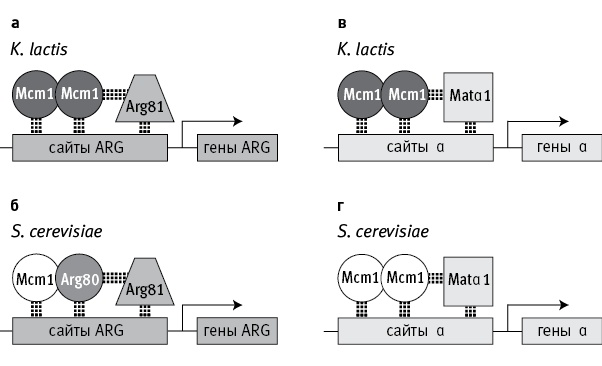
рис. 18.1. Схема регуляции работы генов, связанных с метаболизмом аргинина (гены ARG) и с половым размножением (гены α), у дрожжей Kluyveromyces lactis и Saccharomyces cerevisiae. Комплексы белков-регуляторов присоединяются к регуляторным участкам ДНК (сайты ARG, сайты α) возле контролируемых генов. У K. lactis обе группы генов (ARG и α) регулируются гомодимерами — комплексами из двух молекул белка Mcm1 (а, в). У S. cerevisiae гены α регулируются такими же гомодимерами (г), а для регуляции генов ARG используется гетеродимер, состоящий из Mcm1 и дополнительного регуляторного белка Arg80, которого нет у K. lactis (б). Ген Arg80 появился у предков S. cerevisiae в результате дупликации исходного гена Mcm1 и последующего разделения функций. Arg81 и Matα1 — кофакторы. По рисунку из Baker et al., 2013.
Другая группа генов (гены α, отвечающие за «половые признаки» дрожжей, относящихся к полу α; см. Исследование № 7 и рис. 7.1) у всех дрожжей регулируется одинаково — при помощи гомодимера Mcm1 в комплексе с кофактором Matα1 (рис. 18.1, в, г).
Таким образом, у S. cerevisiae гены α регулируются так же, как у других дрожжей, а гены ARG — более сложным способом, с участием дополнительного белка Arg80, которого у сородичей нет. Исследователи задались целью разобраться в причинах этого различия.
Сравнение последовательностей рассматриваемых генов у разных видов дрожжей показало, что Arg80 произошел от Mcm1 в результате генной дупликации. У предков S. cerevisiae исходный ген, кодировавший белок Mcm1, подвергся удвоению. После этого в двух копиях закрепились разные мутации. Одна из копий (это Mcm1 пекарских дрожжей) изменилась несущественно и сохранила большую часть исходных регуляторных функций, а другая (Arg80) изменилась сильнее и специализировалась на регуляции генов ARG.
На основе аминокислотных последовательностей белков Mcm1/Arg80 всех видов дрожжей, у которых эти последовательности известны, исследователи построили эволюционное дерево, а также реконструировали аминокислотные последовательности трех предковых белков, занимающих на дереве ключевые позиции (рис. 18.2).
Первый из «воскрешенных» белков получил название AncMADS (Anc — от слова ancestor («предок»), MADS — обширная группа регуляторных белков, к которой относится в том числе и Mcm1). AncMADS — это тот белок, ген которого подвергся дупликации у общего предка пекарских дрожжей и их ближайшей родни. Второй реконструированный белок, AncMcm1, — это исходный вариант белка Mcm1 пекарских дрожжей и их родни, то есть одного из двух паралогов, сформировавшихся после дупликации и разделения функций. Наконец, AncArg80 — это исходный вариант второго паралога, белка Arg80.
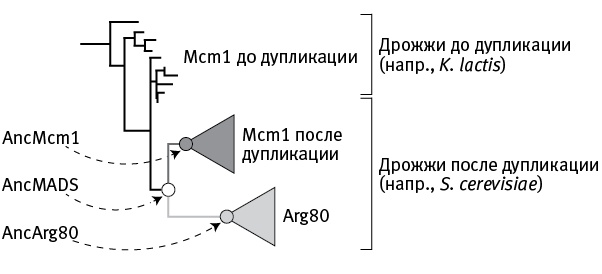
рис. 18.2. Эволюционное дерево белков Mcm1/Arg80. Кружками показано положение трех реконструированных предковых белков. По рисунку из Baker et al., 2013.
Исследователи синтезировали гены реконструированных предковых белков и внедрили их в клетки пекарских дрожжей, у которых их собственные гены Mcm1 и Arg80 были предварительно отключены. Утрата белка Mcm1 смертельна для дрожжей при любых обстоятельствах, а без Arg80 у них нарушается метаболизм аргинина, что критично в среде, где аргинин (или его предшественник орнитин) служит единственным источником азота.
Оказалось, что исходная (до дупликации) версия предкового белка AncMADS прекрасно справляется с работой обоих современных белков Mcm1 и Arg80. То есть в опыте дрожжи, лишенные одного из этих белков или обоих сразу, выживают и нормально размножаются, если в их геном вставлен ген белка AncMADS.
Предковый белок AncMcm1 успешно заменяет современный Mcm1, но не может возместить утрату Arg80. Аналогичным образом предковый белок AncArg80 компенсирует потерю Arg80, но не спасает дрожжи, лишенные Mcm1.
Эти результаты (а также другие экспериментальные данные, но о них мы умолчим, чтобы не пришлось добавлять к этой главе четвертый значок «мозг») показали, что вскоре после дупликации две копии исходного гена, кодирующего белок AncMADS, накопили мутации, которые привели к частичной потере функциональности паралогичными белками. Один из них (AncMcm1) утратил способность соединяться с кофактором Arg81, а другой (AncArg80) разучился связываться с кофактором Matα1 (рис. 18.3).






