Исходным соединением стал дифенил (содержит два бензольных цикла), у которого два заместителя – Sn(CH3)3. Из этого соединения получили цикл, содержащий восемь бензольных ядер и четыре атома платины. Соединение обработали бромом Br2, который «забрал» атомы платины Pt, в результате образовалась лента из одних бензольных циклов (рис. 2.13).
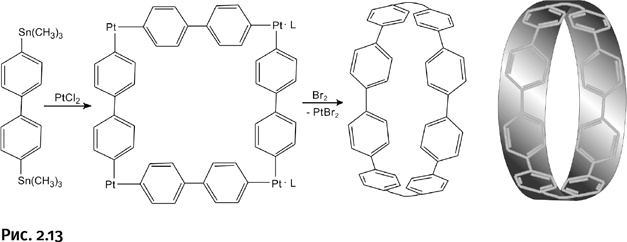
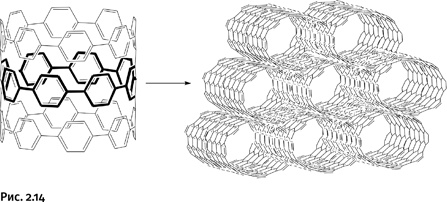
При кристаллизации такого соединения ленты укладываются в цилиндры, которые затем упаковываются в параллельно расположенные трубы (рис. 2.14).
Обычные углеродные нанотрубки получают высокотемпературным испарением графита, они содержат только атомы углерода, а в полученных трубчатых конструкциях есть фрагменты С – Н, т. е. это не углеродные, а углеводородные трубки. Фактически это совершенно новая форма нанотрубок, полученных с помощью органического синтеза. В таких соединениях можно менять состав исходных ленточных заготовок и тем самым направленно изменять свойства всей трубчатой конструкции.
Расплющить углеродную пирамидку
Чрезмерная теснота
не только сближает,
но и плющит.
ЮРИЙ ТАТАРКИН
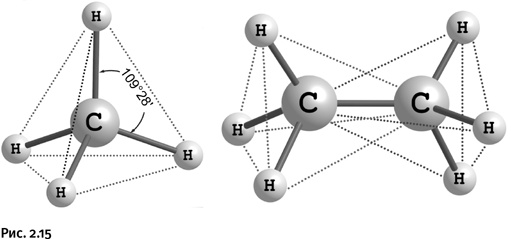
Если атом углерода имеет четыре заместителя, то его химические связи направлены к вершинам мысленного тетраэдра (четырехгранная пирамида), причем сам он находится в центре этой пирамиды. Все углы Н – С – Н одинаковы – 109°28’. На рисунке 2.15 изображены молекулы метана CH4 и этана С2Н6, ребра тетраэдров показаны пунктирными линиями. Это именно то, что называют тетраэдрическим углеродом.
Заместители у атома углерода могут быть различными, не только Н, но и, например, галогены или другие группы, тетраэдрическая конструкция при этом сохраняется. С того момента, когда первый лауреат Нобелевской премии по химии за 1901 г. Я. Вант-Гофф (рис. 2.16) предложил конструкцию тетраэдра, где четырехзамещенный углерод находится в центре мысленной пирамиды, этот факт оставался непреложной истиной. Исследования второй половины ХХ в. показали, что небольшие отклонения от тетраэдра можно наблюдать в тех случаях, когда атом углерода входит в состав напряженных трех- или четырехчленных циклов. Постепенно химиков стала привлекать идея – расплющить такой тетраэдр и получить соединение, у которого все четыре связи атома С лежат в одной плоскости. Современная химия достигла такого уровня, когда исследователи не только изучают закономерности природы, но и пытаются их преодолеть, иными словами, стараются научиться «управлять» веществом.

Вставим атом в оконный переплет
Если в некоторых циклах происходит небольшая деформация тетраэдра, то надо поместить атом углерода внутрь такого цикла, в котором у него не останется иного выбора, как стать «плоским». Так созрела идея получить конструкцию, напоминающую оконный переплет, где в центре находится плоская крестовина. Эти предполагаемые соединения назвали фенестранами (от лат. fenestre – окно).
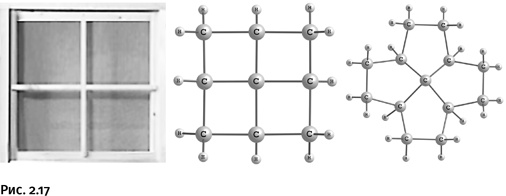
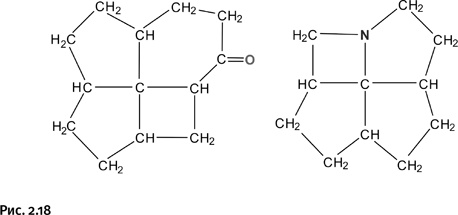
Соединения, показанные на рисунке 2.17, получить не удалось, однако близкие к ним по строению молекулы, содержащие узел «оконного переплета», были синтезированы (рис. 2.18).
Это результаты сложного многостадийного синтеза; полученные молекулы оказались напряженными и потому весьма нестабильными, к тому же валентности центрального атома углерода не располагались в одной плоскости. Таким образом, чисто геометрический подход, основанный на формировании определенной жесткой конструкции, к успеху не привел. Решение следовало искать иным путем.
Плоский углерод существует, но…
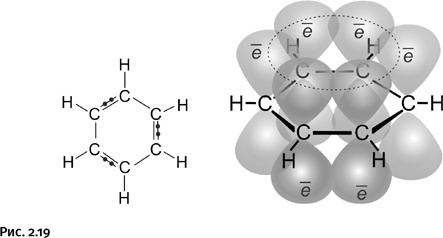
Примеров, когда валентности углерода лежат в одной плоскости, много, но это не четырехзамещенный атом, а трехзамещенный. Атом углерода имеет «плоское» окружение в молекулах этилена и бензола, именно на последнем упомянутом соединении и сосредоточим внимание. В бензоле все атомы, в том числе и атомы водорода, расположены в одной плоскости, это результат сочетания двух условий: необходимо, во-первых, взаимоперекрывание соседних орбиталей в циклической молекуле и, во-вторых, участие «нужного» количества электронов (в случае бензола их шесть). Напомним, что орбиталь – это область наиболее вероятного расположения электрона в пространстве. Одинарные связи бензола рассматривать не будем, сосредоточим внимание на двойных, которые образуются с участием р-электронов, их орбитали имеют форму объемных восьмерок. Электрон на такой орбитали «осваивает» весь объем, располагаясь как в «верхней», так и в «нижней» части восьмерки. Эти орбитали перекрываются, простые и двойные связи усредняются и становятся одинаковыми, молекула приобретает дополнительную устойчивость – такие соединения называют ароматическими (рис. 2.19).
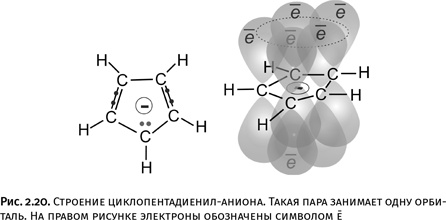
Существуют ароматические циклы и с меньшим количеством атомов: например, циклопентадиенил-анион (анион, полученный из циклопентадиена С5Н6). У него пять атомов в цикле, но главное, что молекула циклическая и участвуют в перекрывании тоже шесть электронов. Одна из точек в центре структуры на рис. 2.20 – это электрон, который оставил атому С ушедший протон Н+. Поэтому вся молекула приобрела отрицательный заряд, т. е. стала анионом, но поскольку соблюдены два упомянутых условия, то соединение тоже ароматическое. У ароматических соединений и сами циклы, и отходящие от них связи всегда лежат в одной плоскости.
Количество электронов, необходимое для образования циклической ароматической системы, определяется правилом Хюккеля: необходимо участие 4n + 2 электронов, где n – число натурального ряда (0, 1, 2, 3 и т. д.). Но если n = 0, то получается, что для образования ароматического цикла достаточно всего двух электронов. Такая молекула существует, это циклопропенил-катион. Если от хлорзамещенного циклопропена отщепить анион Cl– (например, действием SbCl5), то образуется нужный циклический катион, содержащий всего два р-электрона (те, которые образуют двойную связь).
В циклопропенил-катионе имеются две р-орбитали, каждая содержит по одному электрону, и еще освободившаяся пустая орбиталь у «нижнего» углерода, от которого Cl– унес электрон. Три орбитали циклической молекулы перекрываются, и главное, что на них два электрона, т. е. именно столько, сколько требует правило Хюккеля. Трехчленный цикл становится ароматическим, все связи усредняются, молекула стабилизируется, а заряд (+) располагается не на конкретном атоме, а равномерно распределяется по всей молекуле (рис. 2.21).

