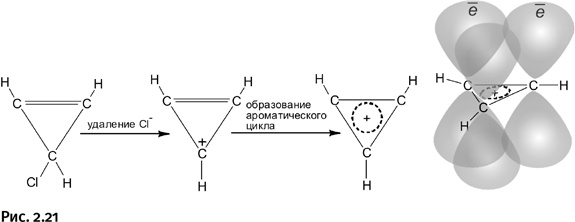
Вновь получился плоский углерод, но не четырехзамещенный, а трехзамещенный: это означает, что у каждого атома С три соседа – два атома углерода и один атом водорода.
Этот катион и навел химиков на мысль, что можно получить ароматический трехчленный цикл, заменив два из трех атомов углерода другими элементами, которые вполне могут быть и не связаны между собой простой химической связью (ароматичность их потом объединит в цикл). В таком случае надо брать элементы, которые образуют только одну химическую связь, т. е. щелочные металлы. Перечисленным условиям удовлетворяет дилитийметан H2CL3.
Именно такое соединение выбрал в 70-е гг. ХХ в. Пол фон Шлейер (Университет Джорджии, США) для теоретических расчетов. В результате он выяснил, что предполагаемый линейный вариант строения молекулы Li-CH2-Li менее энергетически выгоден, нежели угловой, т. е. треугольная форма предпочтительнее (рис. 2.22).
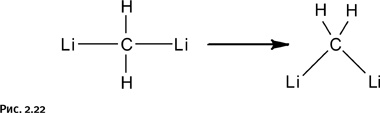
Если это треугольник, то, следовательно, возможно образование ароматического цикла, только, в отличие от рассмотренного циклопропенил-катиона, это не ион, а нейтральная молекула. Впрочем, это не так существенно, важно лишь, чтобы три перекрывающиеся р-орбитали содержали нужное количество электронов, т. е. два. Дилитийметан этим условиям полностью удовлетворяет: каждый из двух атомов лития, образуя связь, отдает по одному электрону атому углерода, в результате р-орбитали атомов лития становятся пустыми, а р-орбиталь атома углерода с двумя полученными электронами перекрывается с этими пустыми (вакантными) орбиталями двух атомов лития и возникает циклическая ароматическая система. Ранее было сказано, что все атомы ароматических циклов и отходящие от них связи всегда лежат в одной плоскости, следовательно, атомы Н и атомы Li, связанные с углеродом (т. е. все четыре валентных штриха), тоже должны лежать в одной плоскости (рис. 2.23).
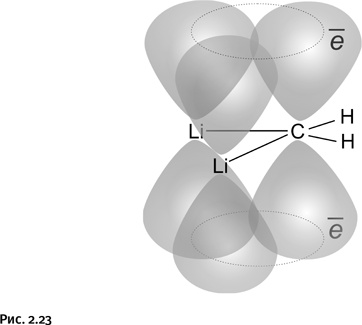
Таким образом, в дилитийметане находится долгожданный плоский углерод.
Напомним, что это итоги теоретических расчетов, которые желательно было подтвердить экспериментально. Химики, естественно, сразу обратили внимание на это соединение, после чего дилитийметан был получен по простой схеме (рис. 2.24).
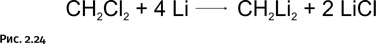
Однако синтезированное соединение образовывало агрегаты из многих молекул [CH2Li2]n, и получить какие-либо экспериментальные подтверждения его структуры не удалось. Тем не менее современные химики уже не сомневаются, что все связи атома С в этом соединении лежат в одной плоскости.
Важная примета современной химии – теоретические расчеты – указали химикам-синтетикам направление поисков.

Очень хочется увидеть плоский углерод
Увидеть молекулу позволяет рентгеноструктурный анализ, но для этого требуется одиночный кристалл без дефектов. Таким образом, требовалось чем-то «укрыть» молекулы дилитийметана (чтобы они не образовывали агрегаты) в надежде получить устойчивое соединение, пригодное для рентгеноструктурного анализа. Такую попытку сделал в 2010 г. профессор Ноттингемского университета в Англии Стефан Лиддл (рис. 2.25). Он решил заменить атомы водорода в дилитийметане объемными группами, которые заодно должны заблокировать атомы лития. И в результате получил соединение, в котором к атому углерода присоединены две фосфорорганические группы, а атомы лития укрыты объемными координирующими молекулами – лигандами (рис. 2.26).
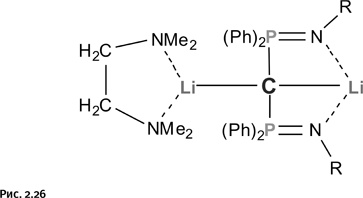
Полученное соединение удалось кристаллизовать, и рентгеноструктурный анализ позволил увидеть его строение. Оказалось, что атомы Li и Р, чередуясь, расположились в вершинах мысленного квадрата. Осталось решить самый главный вопрос: лежат ли все пять атомов (один С, два Li и два Р) в одной плоскости? Рентгеноструктурный анализ дал однозначный ответ. На рисунке 2.27 показано истинное расположение атомов.
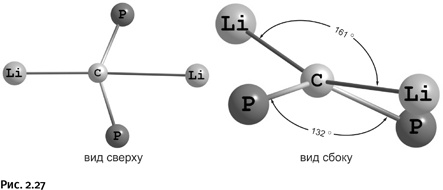
Угол Li-C–Li равен 161°, угол Р-С-Р – 132°. Если бы молекула была плоской, то оба угла были бы 180°. Таким образом, получен «не совсем плоский» углерод. Тем не менее при сравнении этой структуры со структурой метана (см. рис. 2.15), в котором все углы 109°, нельзя не оценить достижение Лиддла, сумевшего так мощно сплющить углеродную пирамидку.
Возникает вопрос: можно ли все же получить абсолютно плоский углерод? Есть все основания полагать, что дилитийметан H2CLi2, скорее всего, абсолютно плоский, причем сплющиванию дополнительно помогает ароматичность трехчленного цикла (молекула Лиддла все же заметно отличается от H2CLi2 по составу). Вполне возможно, что вскоре кому-то удастся предложить свой способ, который позволит аккуратно стабилизировать отдельные молекулы дилитийметана (так, чтобы он не образовывал агрегаты) и затем надежно доказать его структуру.
Создавать затруднения полезно
Мы преодолеваем препятствия,
дабы обрести покой, но, едва справившись с ними,
начинаем тяготиться этим самым покоем.
БЛЕЗ ПАСКАЛЬ
Представьте, что вам часто приходится преодолевать один и тот же путь на автомобиле по хорошему шоссе. Скорее всего, это доставляет удовольствие, поскольку вы заранее знаете, какие пейзажи увидите по пути и сколько времени уйдет на дорогу. Допустим, что в одну из поездок вы обнаружите, что поперек шоссе упало большое дерево, которое сразу объехать невозможно, так как вдоль дороги растет густой кустарник. Вначале возникнет раздражение, но затем вы придете к мысли, что надо искать объезд. Отъехав немного назад, вы увидите, что вбок от шоссе отходит проселочная дорога. Воспользовавшись ею, вы объедете препятствие и через некоторое время вновь выйдете на основное шоссе. Самое интересное, что вместо раздражения из-за потерянного времени вы, скорее всего, испытаете удовольствие от того, что увидите новые места, о существовании которых не подозревали. Кроме того, с удовлетворением убедитесь, что возможности вашего автомобиля далеко не исчерпаны и он способен легко преодолевать участки бездорожья. Таким образом, возникающие трудности могут оказаться полезными.
Подобная ситуация возможна и в химии, только исследователи в поисках новых неожиданных результатов не ждут, когда препятствие возникнет само, а пытаются направленно создать затруднения, которые могут указать совершенно новые маршруты.

