Для этого прежде всего необходимо определить тепловой эффект реакции, иными словами, выяснить, будет ли при этом выделяться или поглощаться тепло. Кроме того, следует взять из справочника (таких справочников существует много) значение теплоты образования каждого из компонентов реакции (эти величины получены в результате термохимических измерений). Затем надо отдельно просуммировать теплоты образования соединений в правой части уравнения и в левой и вычислить разницу между полученными величинами (из правой вычесть левую, а не наоборот!). Такие вычисления вполне доступны каждому, кто знаком с арифметикой.
В нашем случае из теплоты образования уксусной кислоты (правая часть уравнения на рис. 2.55) следует вычесть сумму теплот образования тех соединений, что находятся в левой части уравнения, т. е. СН4 и СО2. В результате узнаем, что реакция проходит с поглощением тепла (31,9 кДж/моль).
Итак, наша реакция проходит с поглощением тепла, поэтому, для того чтобы ее «заставить идти», необходим нагрев. Здесь нет ничего неожиданного: например, реакция разложения карбоната кальция CaCO3 на CaO и CO2 тоже эндотермическая, и для того, чтобы она началась, требуется нагреть CaCO3 до температуры свыше 800 °С (способ получения негашеной извести). Итак, провести эндотермическую реакцию все же возможно, но, к сожалению, не всегда. Помимо энергии реакции, необходимо учитывать еще один важный параметр.
Царица мира и ее тень
Фраза, стоящая в заголовке этого раздела, была ранее выбрана в качестве названия книги, изданной немецким физиком, профессором Ф. Ауэрбахом, в 1919 г. Столь торжественное название тех объектов, о которых далее пойдет речь, вполне применимо и в наши дни.
Царица мира – это энергия. В том, что это действительно так, мы теперь уже не сомневаемся. Вся деятельность человека – строительство зданий, промышленное производство, получение продуктов питания и передача информации – возможна лишь при затрате энергии. В научно-фантастической повести С.Ф. Гансовского «Винсент Ван Гог» (по этой повести был снят фильм «Визит к Ван Гогу») действие происходит в то время, когда человечество освоило перемещение во времени. К этому моменту люди уже научились получать синтетические золото, платину и алмазы, и все они не представляли особой ценности, поэтому во всем мире в качестве основной денежной единицы была утверждена ЕОЭ (единица организованной энергии). В повести не сказано, как хранились и поступали в оборот эти «деньги», но сама идея великолепна! Все материальные блага доступны лишь при наличии энергии. Современные государства не столько обеспокоены пополнением золотых запасов, сколько поиском залежей нефти и газа, а также освоением и разработкой новых источников энергии (атомные станции, солнечные батареи, энергия ветра и т. д.).
Теперь поговорим о тени, которая всегда сопровождает царицу и о которой говорят реже. Речь пойдет об энтропии. Термин был введен в употребление в 1865 г. немецким ученым Рудольфом Клаузиусом (рис. 2.56). Происхождение слова «энтропия» (от греч. ἐντροπία – поворот, обращение внутрь) мало что объясняет. Истинный смысл этого термина – количественная мера беспорядка.

Постепенно термин «энтропия» вошел в химию, физику и в теорию информации. Было установлено, что в большинстве самопроизвольных процессов энтропия возрастает. Житейская практика подтверждает это. Допустим, вы что-то конструируете, используя различные инструменты. После окончания работы вы обязательно заметите, что вокруг возник беспорядок (мусор, разбросанные инструменты), т. е. энтропия самопроизвольно возросла, хотя вы не прикладывали для создания беспорядка специальных усилий. Чтобы навести порядок, приходится совершить определенную работу, т. е. затратить энергию. Даже у очень аккуратных людей в квартире постепенно скапливается пыль по углам, пачкается коврик у входа, загрязняются оконные стекла. В результате приходится тратить силы на наведение порядка.
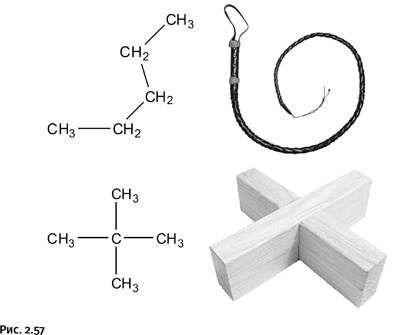
У химии свои взаимоотношения с энтропией. Например, она имеет количественную меру, ее размерность килоджоуль/градус, т. е. энергия, деленная на температуру (обычно указывают величину, приходящуюся на один моль вещества). Молекула каждого вещества имеет свою величину энтропии, которая зависит от того, насколько отдельные части молекулы и сама молекула подвижны при тепловых колебаниях. Чем больше возможных состояний, тем выше энтропия. Здесь играют роль упругость отдельных химических связей и валентных углов, а также общая форма молекулы. Например, у молекулы пентана CH3-CН2-СН2-СН2-СН3 возможны различные повороты пятого, т. е. «хвостового», атома С относительно первого атома – это гибкая плетка. Молекула изомерного пентана С(СН3)4 представляет собой жесткую конструкцию, гибкого хвоста нет, и потому ее энтропия ниже, чем у линейной молекулы (рис. 2.57).
Точно так же, как мы ранее определяли тепловой эффект реакции, значения энтропии веществ можно взять из справочника, они указаны в расчете на один моль вещества. Затем, суммируя энтропии продуктов реакции и вычитая сумму энтропий исходных соединений, можем узнать, каково изменение энтропии в процессе превращения. По существу, это простейшие арифметические вычисления.
Здесь будет уместно сказать, что для получения нужных для вычислений величин (энергии образования и энтропии) химики все реже пользуются справочниками, а обычно поручают это различным компьютерным расчетным программам, пользоваться которыми вполне по силам рядовому химику-синтетику. Дополнительное удовольствие химик получает от того, что может визуально наблюдать процесс расчета, в результате которого молекула приобретает оптимальную форму (энергетически выгодную), что отображается на мониторе в виде 3D-анимации. К тому же можно вычислить необходимые нам величины для соединений, которые пока не получены и существует лишь их формула, написанная на бумаге, а потому, естественно, сведения в справочниках отсутствуют.
Вновь вернемся к энтропии, точнее к ее изменению в процессе реакции. Иногда даже без вычислений, глядя только на схему реакции (например, на ту, которую предложил в самом начале нашего рассказа начинающий химик), можно сказать, что энтропия в результате этой реакции уменьшается. Все дело в том, что из двух молекул получается одна.
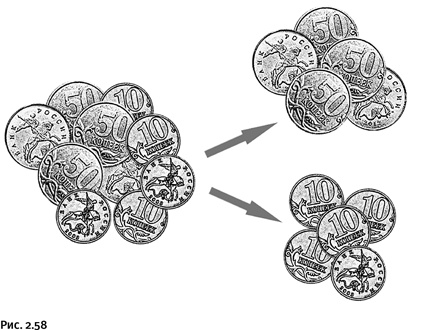
Приведем пример. Представьте небольшую кучку монет достоинством 10 коп. и 50 коп. Монеты располагаются неравномерно, т. е. случайным образом: где-то больше 10-копеечных монет, где-то 50-копеечных. Это система с высокой степенью беспорядка. Уменьшить его мы могли бы, если бы разделили содержимое кучки на две группы так, чтобы в каждой оказались монеты одинакового достоинства. В каждой полученной группе полного порядка все равно не было бы, одни монеты лежали бы вверх гербом, другие – решеткой, да и повернуты они по-разному. Тем не менее после разделения монет на две группы энтропия бы уменьшилась, т. е. порядка стало немного больше (рис. 2.58).