Шарплесс изучал окисление органических веществ, т. е. введение атома кислорода в молекулу. Ему удалось создать несколько катализаторов, которые направляют реакцию в сторону образования только одного оптического изомера. На рисунке 6.3 показано как аллиловый спирт HOCH2-CH=CH2 в присутствии катализатора окисляется до соединения, представляющего собой эпоксидный цикл (трехчленный цикл из двух атомов углерода и одного кислорода). Фактически атом кислорода внедряется в двойную связь. Окислитель – органический пероксид (соединение с группировкой – О-О-), а катализатор представляет собой композицию из тетраизопропоксида титана Ti(OPr-i)4 и диэтилового эфира винной кислоты. Изящество замысла состоит в том, что в состав катализатора входит определенный оптический изомер (энантиомер) эфира винной кислоты, который и направляет всю реакцию в нужную сторону.
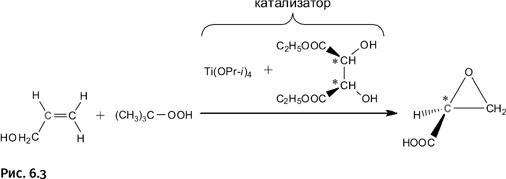
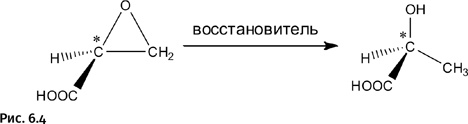
Итак, исходное соединение (аллиловый спирт) не имеет оптической активности. Из него в итоге образуется только один зеркальный изомер, в нем асимметрический центр (атом С, отмеченный звездочкой), имеющий четыре различных заместителя (ближайшие к нему соседние группы). Этот атом находится в составе эпоксидного цикла (это треугольник из двух атомов С и одного атома О на рис. 6.4). Эпоксидные циклы весьма реакционноспособны, при восстановлении полученного эпоксидного соединения образуется один из зеркальных изомеров той самой молочной кислоты, которая была показана выше.
Синтезированные по методу Шарплесса различные эпоксидные производные использовали в качестве строительных блоков при производстве лекарственных веществ для кардиологии, а также для синтеза углеводов, витаминов, антибиотиков, ароматизаторов, пестицидов, пищевых добавок. Катализаторы Шарплесса довольно быстро были доведены до промышленного использования. За эти исследования Б. Шарплесс был удостоен в 2001 г. Нобелевской премии по химии.
Провести реакцию – как кликнуть мышкой
Добившись успехов в асимметрическом катализе, Шарплесс изменил область интересов. Все началось с того, что он сформулировал набор требований к органическим реакциям нового типа. Список выглядел следующим образом:
а) условия проведения реакции должны быть простыми, желательно без нагрева;
б) исходные реагенты должны быть доступны и охватывать широкий круг реакций;
в) используемые растворители должны быть распространенными и нетоксичными (предпочтительна вода);
г) выделение продукта из реакционной смеси должно быть простым;
д) реакция должна протекать с высоким выходом основного продукта;
е) продукт реакции в процессе синтеза не должен вступать в побочные реакции;
ж) побочные продукты вообще нежелательны, а если они образуются, то должны быть инертными;
з) реакция должна протекать быстро.
При знакомстве с этим списком требований возникает ощущение, что Шарплесс просто изложил мечту каждого химика. Вероятно, многие химики-органики могли бы составить похожий список как символ несбыточных грез. Но Шарплесс сумел найти реакцию, удовлетворяющую перечисленным параметрам. Оказалось, что это давно известная реакция Артура Михаэля, открытая еще в 1893 г.: взаимодействие алкинов (производных ацетилена) с азидами (соединениями, содержащими группировку N3). В результате образуется триазольный цикл, т. е. цикл с тремя атомами N (рис. 6.5).
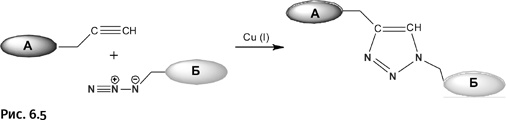
Ранее эта реакция не представляла никакого интереса, поскольку протекала очень медленно (в течение суток при 120 °С) и с низким выходом основного продукта.
Все резко изменилось после того, как в 2002 г. замысел Шарплесса решил реализовать его коллега Валерий Фокин (рис. 6.6), о котором следует рассказать немного подробнее. Выпускник Нижегородского государственного университета, а сейчас профессор калифорнийского Института Скриппса, В. Фокин работает еще и в Московском физико-техническом институте над совместным проектом, а также возглавляет открытую недавно лабораторию химического синтеза на базе этого института. В 2013 г. международные агентства предсказывали ему получение Нобелевской премии за работу, о которой далее пойдет речь, но пока этого не произошло.

Итак, В. Фокин нашел катализатор реакции Михаэля – это соединения одновалентной меди Cu+. С такими катализаторами реакция протекает в воде почти мгновенно и без образования побочных продуктов, т. е. требования к «идеальной» реакции, перечисленные Шарплессом, удалось реализовать. Шарплесс назвал ее клик-реакцией (click-reaction) по аналогии с нажатием на клавишу компьютерной мыши.
Буквально сразу же многие химики-органики стали изучать эту реакцию, используя различные производные алкинов и азидов. По общему мнению, успех был ошеломляющий, и скоро в литературе появился новый термин «клик-химия» (click-chemistry).
На самом деле Шарплесс, формулируя перечисленные выше требования, имел в виду не всю химию вообще, он мысленно ориентировался на биохимические исследования. Особую ценность найденной реакции придает то обстоятельство, что азиды и триазолы (участники клик-реакции) не встречаются в живых организмах и инертны к веществам, которые присутствуют в биологических средах. Поэтому если в природную молекулу ввести ацетиленовый фрагмент – С≡СН, то органический азид N3–R будет присоединяться исключительно к этой определенной молекуле. При этом присоединившийся азид может содержать метку: например, такую, которая флуоресцирует в ультрафиолетовом свете. Специалисты по клик-реакциям называют подобные «довески» молекулами-репортерами, которые позволяют следить за объектом и при этом не нарушают идущие в нем процессы (в отличие от обычной жизни, где различные репортеры иногда мешают какому-нибудь мероприятию ☺).
В результате клик-реакции нашли множество применений: зондирование и ингибирование ферментов, наблюдение за синтезом протеинов и ДНК, прикрепление флуоресцентных меток к вирусам и многое другое.
Тем не менее найденный метод, превосходно «работающий» на препарированных образцах, оказался непригоден для изучения живых организмов, поскольку катализаторы – соединения Cu+ – токсичны. Эту трудность удалось преодолеть; оказалось, что если изменить строение реагента, содержащего ацетиленовый фрагмент, например ввести – C≡C- в состав восьмичленного углеродного цикла, то клик-реакция протекает столь же быстро и однозначно без катализаторов (рис. 6.7).
В результате появилось направление «клик-химия без меди» (Copper-free Click Chemisty). В настоящее время созданы крупные базы исходных реагентов для клик-реакций, содержащих фрагменты аминокислот, нуклеотидов, флуоресцентных красителей. Все это позволяет направленно модифицировать биологические объекты и наблюдать за их превращениями в клетках.

