Другая сторона вопроса не менее важна. Для того чтобы возникли α-частицы, необходимо облучить организм нейтронами, но не затронут ли они также здоровые клетки? В данном случае использование атомов бора как потенциальных «захватчиков» нейтронов неслучайно. Дело в том, что способность атомов бора захватывать нейтроны на 4–7 порядков превышает аналогичные свойства атомов, входящих в состав тканей живых организмов, – C, H, O, N (именно поэтому соединения бора применяют в ядерных реакторах в качестве поглотителей нейтронов). Таким образом, нейтронное излучение не будет оказывать на организм разрушающего действия. Практически все поступающие нейтроны будут захвачены бором. Осталось решить важную часть задачи – ввести в раковые клетки борсодержащее соединение.
Как можно больше бора
Из общих соображений понятно, что препараты, вводимые в ткани живого организма, должны быть нетоксичны и водорастворимы. Поэтому исследователи в начале 1950-х гг. сосредоточили свое внимание на борной кислоте и ее производных. Клинические испытания показали, что такие препараты неэффективны: они не позволяли получить достаточно высокую концентрацию атомов бора в тканях и, кроме того, не обладали избирательной способностью накапливаться преимущественно в опухолевых клетках.
Возникла задача получить соединения, лишенные указанных недостатков. Поиск молекул с большим числом атомов бора в молекуле естественно привел к каркасным гидридам бора, среди которых наиболее известен карборан, ставший эмблемой химии бора в конце ХХ в. На рисунке 8.11 показана его структурная формула и условное обозначение в виде каркаса из шариков и палочек.
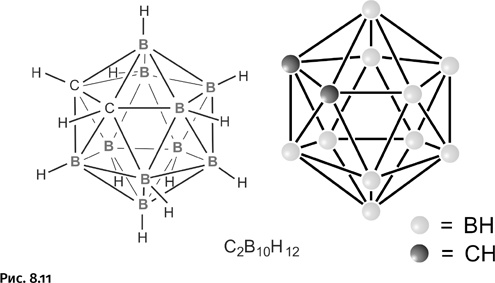
На первый взгляд кажется, что атомы бора и углерода шестивалентны – шесть валентных связей у каждого атома. На самом деле обычные валентные связи лишь у группировок В – Н и С – Н, а остальные представляют собой связи особого типа. Способ соединения элементов в каркас здесь необычный. Появление карборана открыло в химии новую главу, описывающую соединения, построенные с помощью нетрадиционных трехцентровых связей.
Природу связей в таких соединениях обсудим на простом примере, рассмотрев строение одного из бороводородов – диборана, содержащего всего два атома бора: Н3В – ВН3 (гидриды бора называют также боранами).
До середины 1950-х гг. не было ясно, каким образом бороводороды, например В2Н6, напоминающий по составу этан, или тетраборан В4Н10 – аналог бутана, образуют цепочечные структуры, где атомы бора соединены непосредственно друг с другом. У атома бора всего три валентных электрона, и поэтому в молекуле простейшего гидрида BH3 у атома бора не осталось электронов для образования дополнительных связей. В таком случае неясно, как же соединены атомы бора в В2Н6 или В4Н10. Понятно, что классические представления, где два атома связаны одной парой электронов, в этом случае непригодны. В 1950-е гг. было сформулировано понятие трехцентровых связей. В диборане В2Н6 атомы бора непосредственно не связаны друг с другом. Они соединяются с помощью атомов водорода. На рисунке 8.12 показано, как сферическая s-орбиталь водорода пересекается одновременно с двумя вытянутыми p-орбиталями двух атомов бора (орбиталь характеризует область наиболее вероятного расположения электрона в пространстве, ее геометрический образ – электронное облако определенной формы). Образуются две такие связи над и под мысленной плоскостью, в которой расположены фрагменты ВН2.
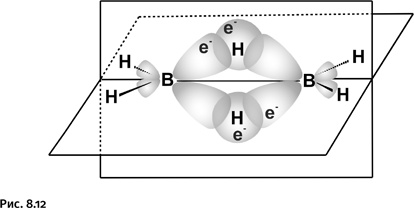
Таким образом, в связь В – Н, лежащую над плоскостью и образованную традиционной парой электронов, вовлекается еще один атом бора (расположенный справа), который для образования связи электрона не поставляет, он участвует своей вакантной, т. е. не занятой орбиталью (на рисунке эта орбиталь не содержит электрона). В результате два атома бора и один атом водорода – три центра – оказываются связанными двумя электронами (такую связь называют трехцентровой двухэлектронной).
Как же изобразить формулу диборана? В настоящее время ее пишут, используя обычную схему валентных связей (рис. 8.13).
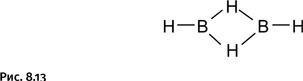
При этом водород выглядит двухвалентным, что совершенно необычно, однако химики понимают, что это трехцентровая связь и водород в данном случае мостиковый. Такое обозначение уже стало привычным.
Трехцентровые связи могут реализоваться не только в треугольнике из двух атомов бора и одного атома водорода, но и между тремя атомами бора (без участия водорода), например в карборане. Каждый атом бора предоставляет для образования связей четыре орбитали (четвертая орбиталь вакантная) и три электрона. В карборане присутствуют еще два атома углерода, они также участвуют в образовании трехцентровых связей и составляют неотъемлемую часть каркаса. Атомы водорода, окружающие каркас карборана (связи В – Н и С – Н), не принимают участия в образовании трехцентровых связей, они доступны для дальнейших превращений, о чем будет рассказано ниже.
Химия карборана изучена весьма детально, и потому вопрос о направленной его модификации для решения задачи, намеченной в начале рассказа, мог быть решен без особо изнурительных поисков, что делало карборан особенно привлекательным для химиков.
Улучшенный вариант
Довольно быстро выяснилось, что карборан имеет ряд недостатков, затрудняющих его использование для решения поставленной задачи. Это соединение гидрофобно (водоотталкивающие свойства), что затрудняет его введение в ткани живого организма, в результате возникает необходимость дополнительно вводить в карборан различные гидрофильные группы, которые позволят в конечном итоге получить водорастворимый препарат.
Этот недостаток отсутствует у аниона [B12H12]2-, содержащего 12 атомов бора и называемого додекаборат-анионом (от греч. додека – двенадцать).
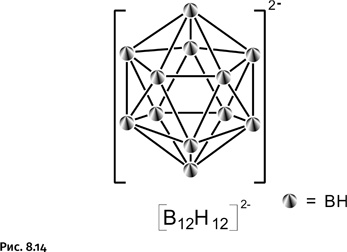
Этот анион (рис. 8.14) представляет собой многогранник с точно такой же структурой, что и у его знаменитого «родственника» – карборана. Додекаборат-анион обладает рядом преимуществ, которые делают его предпочтительным для использования в лечебном процессе: он содержит большее количество атомов бора, чем карборан, способы его получения весьма многочисленны: например, он образуется в том или ином количестве практически при всех пиролитических реакциях (терморазложение) бороводородов. К тому же анион [B12H12]2– гидрофилен (водорастворим) и обладает очень низкой токсичностью.
Опыт, накопленный биохимиками, позволил определить те функциональные группы, которые следует присоединять к борному каркасу, чтобы обеспечить накопление препарата в опухолевых клетках. Наиболее предпочтительны аминогруппы (–NH2), цианатные (–NCO), карбоксильные (–СООН) и изотиоцианатные (–NCS) группы. Важно также, как именно должны располагаться вводимые функциональные группы около каркаса. При последующем взаимодействии функциональной группы с белковой молекулой борное ядро создаст пространственные затруднения, и, чтобы это устранить, необходимо располагать активную группу на некотором удалении от каркаса, отодвинув ее с помощью цепочки из трех – пяти атомов. По замыслу вся конструкция для охоты за опухолевыми клетками должна напоминать удочку с поплавком (борным ядром) и расположенным на некотором удалении крючком – активной функциональной группой (рис. 8.15).

