Мы продумали эксперимент в соответствии с этой идеей. Нам нужно было проверить, может ли одна эта гибридная молекула РНК все так же направлять Cas9 к подходящей последовательности ДНК для разрезания последней. Также наш эксперимент должен был показать, действительно ли Cas9 можно запрограммировать на разрезание любой желаемой последовательности ДНК (как мы предполагали), а не только тех последовательностей ДНК фагов, которые были естественным путем отобраны системой CRISPR в ходе эволюции бактерий.
Исходя скорее из удобства, чем какого-либо предпочтения, – мы понимали, что совершили серьезный прорыв, и не хотели откладывать эксперимент из-за того, что под рукой нет подходящего гена, – мы решили использовать ген медузы, кодирующий зеленый флуоресцентный белок (green fluorescent protein, GFP). Этот белок широко используется в лабораториях по всему миру для визуализации клеток и белков в их составе и стал настолько важным биотехнологическим инструментом, что в 2008 году принес группе ученых: Мартину Чалфи, Осаму Симомуре и Роджеру Тсиену – Нобелевскую премию по химии. Мартин Йинек выбрал пять различных последовательностей длиной в двадцать “букв” внутри гена-мишени и затем создал пять гибридных молекул РНК, точно совпадающих с ними. Как только гибридные РНК-гиды были готовы, мы использовали их вместе с Cas9 и ДНК медузы в уже привычном для нас опыте по разрезанию ДНК и стали ждать результатов.
Когда Мартин показал мне результаты эксперимента с GFP на одном из лабораторных компьютеров, рентгенограмма на экране монитора выглядела замечательно. Все ДНК GFP были разрезаны в заданных местах. Каждая гибридная молекула РНК сработала именно так, как нужно, выбрав именно тот участок ДНК медузы, который мы хотели надрезать и в паре с Cas9 разбить ее именно в том месте.
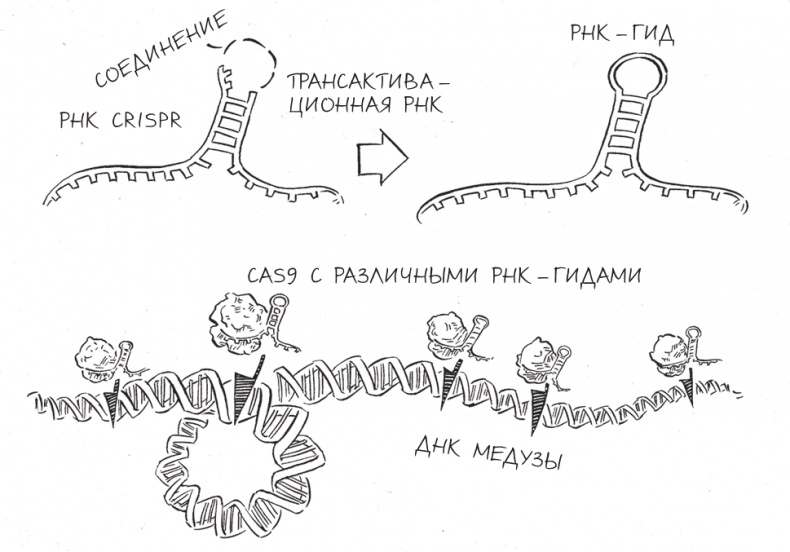
Программируемая нарезка ДНК посредством CRISPR-Cas9
Мы сделали это. За короткое время мы создали и протестировали новую технологию, которая, основываясь на исследованиях белков ZFN и TALEN, давала возможность редактировать геном – любой геном, а не только геномы бактериофагов. Из этой пятой системы вооружения бактерий мы сделали средство для переписывания кода жизни.
В тот вечер, пока я стояла у плиты и готовила ужин, в моей голове танцевали видения этой крошечной машины: Cas9 и его направляющая РНК, снующие по бактериальной клетке, охотящиеся на комплементарные последовательности ДНК. Внезапно я осознала, что громко смеюсь. Как же невероятно, что эта бактерия нашла способ запрограммировать для себя белок, сделав из него воина для поиска и уничтожения вирусной ДНК! И как же здорово, какое это фантастическое везение, что мы смогли приспособить этот фундаментальный механизм для совершенно других нужд. Это было удивительное время чистого наслаждения, наслаждения от открытия – такого же чувства, какое я испытала в лаборатории доктора Хеммеса много лет назад.
В июне 2012 года Эммануэль и Кшиштоф прилетели в Беркли на конференцию, благодаря чему у нас с Мартином появился шанс снова увидеться с ними лично. Учитывая, какой путь мы проделали вместе как ученые, было удивительно, что наше общение до того момента было почти полностью виртуальным. После бесчисленных телефонных звонков, бесед по скайпу и обмена электронными письмами мы все сидели в моем кабинете в Беркли, поражаясь результатам нашего недолгого, но интенсивного сотрудничества.
Эммануэль и Кшиштоф прибыли в Калифорнию на пятую ежегодную конференцию, посвященную CRISPR, – мероприятие, которое в 2012 году собрало исследователей из двадцати – тридцати лабораторий. Большинство этих ученых специализировались на науке о продуктах питания и микробиологии. CRISPR пока что еще не привлекал особенного внимания более широкого научного сообщества; за предшествующее десятилетие было опубликовано лишь около двухсот научных статей с упоминанием этой системы. Но мы знали, что скоро все изменится.
Время конференции не могло быть выбрано лучше – или хуже. С одной стороны, мы могли сравнить нашу работу с работами коллег. С другой стороны, предшествующие несколько недель были невероятно, до исступления бурными, и все мы хотели отдохнуть.
После эксперимента с GFP мы решили завершить проект как можно быстрее и опубликовать научную статью по его итогам. Еще до того, как Мартин и Кшиштоф закончили свои опыты, а наши зарубежные коллабораторы стали готовиться к поездке в Беркли, мы с Эммануэль начали писать ее.
Главной темой статьи было объяснение механизма работы CRISPR для противовирусной защиты у S. pyogenes, но мы также хотели отметить некоторые важные следствия из наших результатов. В аннотацию к статье мы включили упоминание того, что программируемый фермент, разрезающий ДНК, может быть использован для редактирования генома. Вдобавок мы завершили статью коротким, но значимым очерком возможных областей применения CRISPR не только в бактериях, но и в других типах клеток. Упомянув ZFN и TALEN, мы в заключение написали следующее:
Мы предлагаем альтернативный метод, основанный на программируемом с помощью РНК ферменте Cas9, который может представлять значительный потенциал для применения в сферах направленного воздействия на гены и редактирования генома
[78].
Сидя за компьютером в солнечную пятницу восьмого июня 2012 года, я нажала на кнопку “Подтвердить” в форме для представления статей на рассмотрение в журнал Science. Ее опубликуют всего двадцать дней спустя, 28 июня, и после этого уже ничто не будет прежним – ни для меня, ни для моих соратников, ни для биологической науки. В тот момент, однако, мое восхищение этим знаковым моментом было приглушено. Я была измотана, как никогда в жизни.
У меня появилось ощущение, что я сидела за столом много недель, поэтому я поднялась и – в некотором оцепенении – вышла из Стэнли-холла в полный зелени кампус Беркли. Лужайка вокруг круглого бассейна перед нашим зданием была подозрительно пустой. Весенний семестр закончился уже почти месяц назад; в кампусе, обычно бурлящем жизнью, было пугающе тихо.
И это, как я теперь понимаю, было затишье перед бурей.
Глава 4
Управление войсками
Примерно через год после того, как наша статья о CRISPR вышла в журнале Science, я оказалась в Кембридже, штат Массачусетс, – в первой своей поездке по стране для обсуждения нашего открытия (впоследствии такие поездки случались каждый месяц).
То был июнь 2013-го, и я отправилась в Гарвардский университет, чтобы встретиться там с восходящей звездой с местной кафедры изучения стволовых клеток и регенеративной биологии. Кабинет профессора Кирана Мусунуру находился в здании имени Шермана Фэйрчайлда, в котором я слушала лекции по химии в 1980-х, когда была аспирантом. Тридцать лет спустя здание снаружи выглядело почти так же, но внутри его полностью обновили. Ушли в прошлое старомодные потоковые аудитории и биохимические лаборатории с устаревшим оборудованием. На смену им пришли белые, просторные, ярко освещенные помещения, оборудованные по последнему слову техники. В тот день, когда я была там, это современное пространство кипело жизнью: десятки исследователей работали сообща ради разгадки самых глубоких тайн клеток и тканей.



