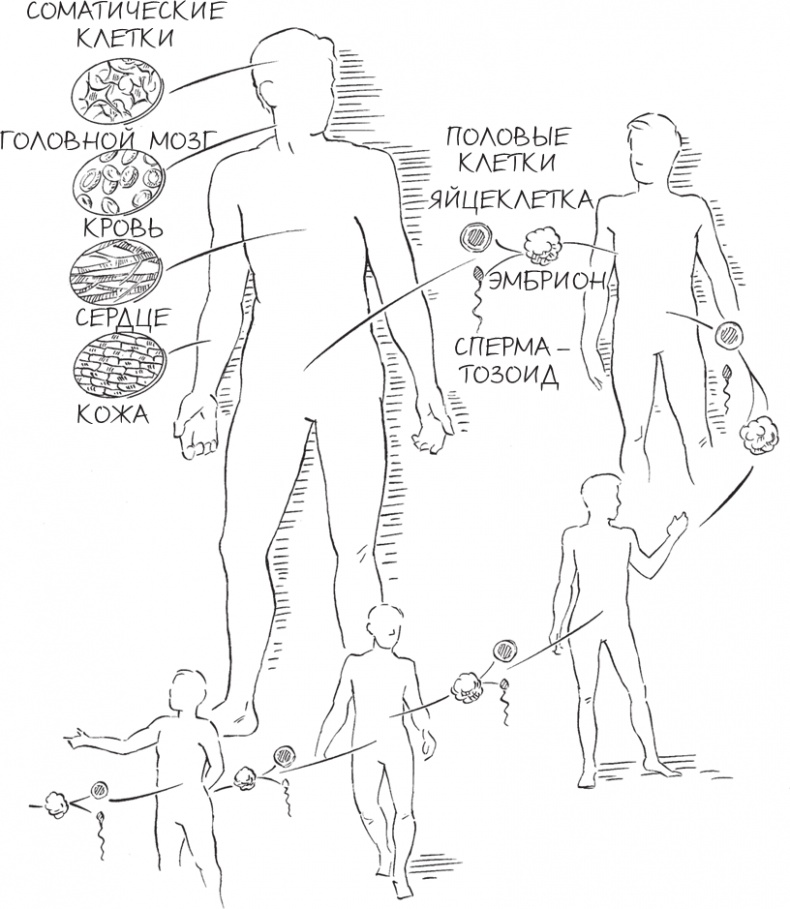
Различия между соматическими и половыми клетками
С этической точки зрения с редактированием соматических клеток для лечения генетических болезней все обстоит гораздо проще, чем с редактированием половых клеток, поскольку изменения в первых не могут передаться потомкам пациента. На практике, правда, все намного сложнее. Исправить патогенную мутацию в одной-единственной половой клетке намного проще, чем пытаться сделать то же самое примерно в пятидесяти триллионах соматических клеток, составляющих человеческое тело. Чтобы обойти это препятствие, ученым придется решить ворох новых проблем – но это нам придется сделать, если мы хотим помочь множеству мужчин, женщин и детей, страдающих генетическими заболеваниями. В таких случаях редактирование половых клеток никак не поможет облегчить страдания: уже слишком поздно. Редактирование генома соматических клеток – единственный способ.
Трудно себе представить, что редактирование генома может обратить вспять течение заболевания у любого человека, и уж тем более у взрослого, который существовал с этим заболеванием всю жизнь. Болезнь к моменту начала генной терапии может укорениться уже очень глубоко, и изменение ДНК пациента не обязательно избавит его от накопившихся в течение жизни последствий поломки генетического кода.
Разумеется, есть границы того, что мы можем делать с помощью CRISPR в этом ключе. Некоторые заболевания не имеют четко известных генетических причин, и при определенных недугах, таких как шизофрения или ожирение, генетике отводится сложносоставная роль: многие гены вовлечены в развитие патологии, но каждый привносит лишь небольшой вклад. Учитывая, как тяжело будет использовать CRISPR для безопасного и эффективного редактирования единственного гена в человеческом теле, вряд ли мы в обозримом будущем сможем одновременно редактировать несколько генов сразу.
CRISPR дает наиболее широкие возможности для лечения моногенных наследственных заболеваний – таких, которые вызываются мутацией в одном-единственном гене. Говоря простыми словами, эти заболевания возникают, если в результате экспрессии мутантного гена либо получается дефектный белок, либо вообще не образуется белка. Если редактирование гена сможет восстановить нормальное производство полностью функционального белка до того, как генная мутация нанесет непоправимый вред, то это редактирование может стать одноразовым вмешательством, терапевтический эффект которого продержится до конца жизни пациента. Это отличает генную терапию от существующих сегодня способов лечения генетических заболеваний, которые обычно заключаются во временных решениях с использованием трансплантатов или периодических введений лекарств. Что важно, врачам не нужно будет редактировать все клетки тела пациента, чтобы излечить генетическое заболевание. Даже если все клетки несут патогенную мутацию, симптомы зачастую проявляют себя только в тех тканях, где наиболее важно нормальное функционирование мутантного гена. К примеру, иммунодефициты по большей части влияют на белые кровяные тельца; хорея Гентингтона в первую очередь губит нейроны головного мозга; серповидноклеточная анемия затрагивает только красные кровяные тельца, а муковисцидоз наносит ущерб по большей части легким. А коль скоро проявления генетических заболеваний локальны, то и методы их лечения должны быть направлены на клетки в наиболее затронутых болезнью частях тела. Никто не говорит, что будет легко доставить CRISPR в эти места и уж тем более – внедрить его именно в нужные клетки. Задача доставки – одна из главнейших проблем, с которыми столкнутся технологии редактирования генома соматических клеток.
Доступные стратегии доставки можно разделить на две основных категории: редактирование генома in vivo (от латинского “в живом”, как упоминалось ранее) и редактирование генома ex vivo (от латинского “вне живого”). В рамках первого подхода CRISPR направляют прямо в тело пациента, чтобы инструмент проделал свою работу в месте повреждения; в рамках второго клетки пациента редактируют вне тела пациента и затем возвращают в него. Терапия ex vivo – гораздо более простой подход, и поскольку ученые освоили редактирование геномов клеток в лаборатории, мы на один шаг ближе к ней, чем к генной терапии in vivo. Другое преимущество редактирования генома ex vivo заключается в том, что клетки с отредактированными генами можно подвергнуть строгому контролю качества, прежде чем возвращать их в тело пациента.
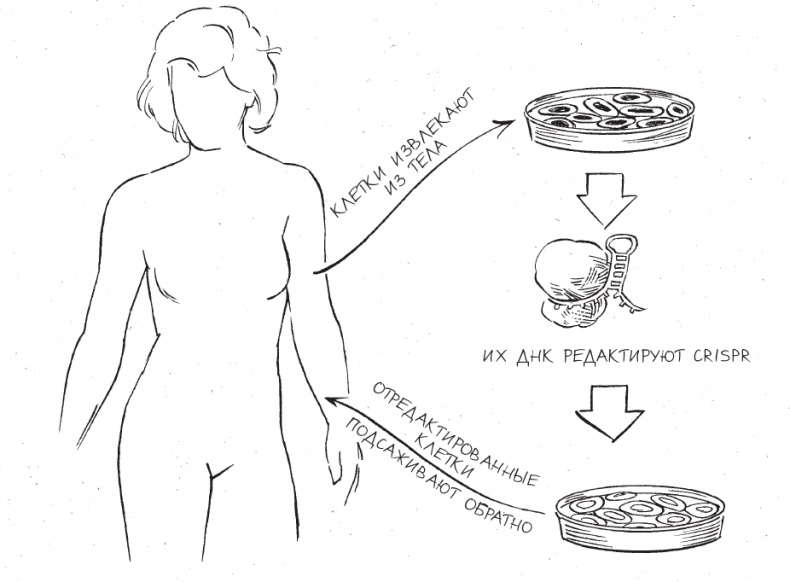
CRISPR-терапия ex vivo
Поскольку для редактирования генома ex vivo необходимо извлечь больные клетки из тела пациента, этот метод отлично подходит для терапии заболеваний крови. Используя комбинацию редактирования генома, донорства крови и методов ее переливания, врачи могут изъять пораженные клетки крови из тела пациента, отредактировать их с использованием CRISPR и вернуть в кровеносную систему. Две потенциальных мишени для CRISPR-терапии ex vivo – это серповидноклеточная анемия и бета-талассемия. Оба эти генетических заболевания характеризуются тем, что возникают из-за дефектов молекулы гемоглобина – это главная белковая составляющая красных кровяных телец, вещество, переносящее кислород от легких к другим тканям тела. Причины дефектов в этой молекуле – мутации в гене бета-глобина, кодирующем одну из двух уникальных белковых цепочек, составляющих молекулу гемоглобина.
Серповидноклеточную анемию и бета-талассемию и сегодня можно полностью вылечить пересадкой красного костного мозга. Когда врачи пересаживают костный мозг от здорового донора больному реципиенту, стволовые клетки крови, коих множество, начинают образовывать новые здоровые красные кровяные тельца, и этот процесс работает до конца жизни пациента. Проблема с этим типом пересадки стволовых клеток заключается в нехватке здоровых доноров, которые одновременно подходят реципиенту с иммунной точки зрения и согласны пройти инвазивную процедуру. Даже когда подходящий донор найден и тело пациента приняло пересаженные клетки, процедура несет определенные риски; у многих больных развивается болезнь “трансплантат против хозяина”, вариант обратной иммунной реакции, который может привести к летальному исходу.
Редактирование генома может решить эту проблему, позволяя пациентам одновременно играть роль и реципиента, и донора стволовых клеток. Если врач сможет изолировать стволовые клетки из красного костного мозга пациента, “починить” мутантные гены с помощью CRISPR, а затем вернуть эти отредактированные клетки пациенту, то не придется думать о доступности донорского материала и о риске иммунного конфликта между телом пациента и пересаженными клетками. Многочисленные исследовательские коллективы уже убедительно показали, что геномы клеток пациентов можно с высокой точностью репарировать в лаборатории и что эти отредактированные клетки производят заметные количества здорового гемоглобина; ученые даже показали, что отредактированные клетки человека могут функционировать в теле иммунокомпрометированных (то есть имеющих ослабленный иммунитет) мышей. Сегодня исследователи и в научных учреждениях, и в коммерческих компаниях работают над тем, чтобы сделать эту процедуру доступной для пациентов.




