В начале 1990-х годов проводившие эксперименты молекулярные биологи получили ряд неожиданных результатов, которые никто не мог объяснить. Самые поразительные эффекты наблюдали ученые, занимавшиеся биологией растений. Они пытались сделать цвет лепестков петунии более интенсивным и для этого вводили в ДНК растения ген, вызывающий образование красного пигмента в цветах. Однако цвет петуний не стал интенсивнее, он просто пропал, лепестки стали белыми! Механизм, вызвавший этот эффект, оставался загадочным до тех пор, пока молекулярные генетики из США Эндрю Файер и Крейг Мелло не совершили «открытие РНК-интерференции — гашения активности генов с помощью двухцепочечной РНК», за которое получили в 2006 году Нобелевскую премию.
Файер и Мелло изучали, как экспрессия генов регулируется у червей. Сначала ученые вводили им мРНК, кодирующую мышечный белок, и наблюдали поведение червей. Оно не отличалось от обычного.
Затем Файер и Мелло сделали другой группе червей инъекцию, содержащую мРНК с последовательностью нуклеотидов, комплементарной первой, так называемую антисмысловую мРНК. Ее можно сравнить с зеркальным отражением первой мРНК — смысловой.
Инъекция антисмысловой РНК также не повлияла на поведение червей. Но после того, как Файер и Мелло ввели смысловую и антисмысловую РНК одновременно, они заметили, что черви стали совершать странные резкие движения. Такое поведение ученые до того наблюдали у червей, полностью лишенных гена, который кодирует мышечный белок. Что же произошло?
Смысловые и антисмысловые молекулы РНК встретились. Они связались друг с другом (так как были комплементарны) и образовали двухцепочечную РНК. Может ли быть так, что молекула двухцепочечной РНК подавила активность гена, содержавшего тот же код, что и эта самая РНК? Файер и Мелло подтвердили эту гипотезу, введя молекулы двухцепочечной РНК, кодирующие нескольких других белков червя. В каждом эксперименте инъекция двухцепочечной РНК приводила к замалчиванию гена, содержавшего именно соответствующий введенной РНК код в одноцепочечной РНК. Белок, кодируемый этим геном, больше не синтезировался.
Такое замалчивание гена с помощью молекулы РНК и называется РНК-интерференцией, а РНК называется интерферирующей.
После серии экспериментов Файер и Мелло пришли к двум выводам. Первый: двухцепочечная РНК может заглушать гены, код которых соответствует коду молекулы введенной РНК. Второй: интерферирующие РНК могут передаваться от клетки к клетке и даже наследоваться. При этом для значительного подавления гена требовалось крошечное количество соответствующей ему интерферирующей РНК.
Файер и Мелло опубликовали результаты своего исследования в журнале Nature в 1998 году. Их открытие прояснило многие запутанные и противоречивые экспериментальные наблюдения и объяснило естественный механизм контроля над потоком генетической информации. Так в генетике появилась новая область исследований.
В последующие годы были установлены все компоненты механизма РНК-интерференции. Двухцепочечная РНК связывается с белковым комплексом Dicer (от англ. dice — нарезать), расщепляющим ее на фрагменты. Другой белковый комплекс, RISC (RNA-induced silencing complex — РНК-индуцируемый замалчивающий комплекс), связывает эти фрагменты. Одна из нитей РНК удаляется, но другая остается связанной с комплексом RISC и служит в качестве зонда для обнаружения молекул матричной РНК (мРНК). Когда молекула мРНК комплементарно связывается с фрагментом РНК на белковом комплексе RISC, он распознает ее и расщепляет, после чего мРНК деградирует, то есть распадается на малые фрагменты. Белок, кодируемый этой мРНК, не экспрессируется — ген замалчивается!
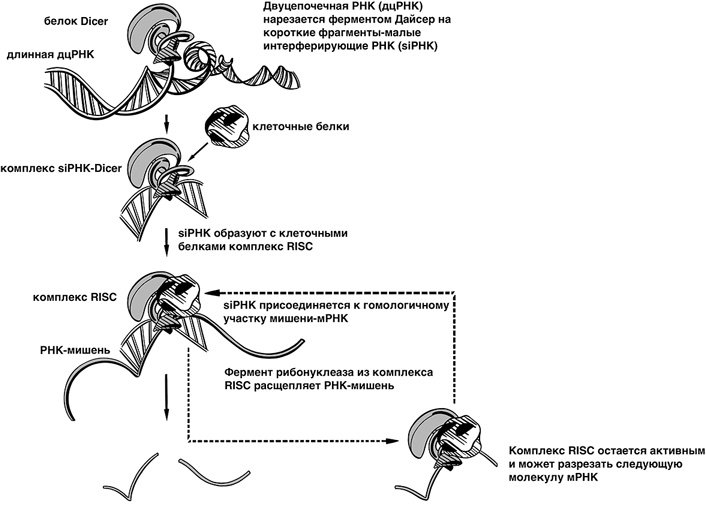
Рис. 27. Схема механизма РНК-интерференции
Оказалось, что РНК-интерференция заглушает гены не просто так! Это делается для защиты клетки от вирусов, особенно у низших организмов. Генетический код многих вирусов записан именно на двухцепочечную РНК. Когда такой вирус заражает клетку, он вводит в нее свою молекулу РНК, которая немедленно связывается с Dicer. Комплекс RISC активируется, вирусная РНК деградирует, и клетка выживает. В дополнение к этому способу защиты высокоразвитые организмы (такие, как человек) разработали эффективную иммунную защиту, включающую антитела, клетки-киллеры и интерфероны.
Но самое удивительно, что иногда РНК-интерференция защищает организм не только от вирусов, но и от самого себя! Точнее, от его же собственных генов. Так называемые транспозоны представляют собой последовательности ДНК, которые могут перемещаться в геноме. И если они попадут в неправильное место, то могут нанести организму серьезный ущерб. Многие транспозоны работают путем копирования собственной ДНК в РНК, которая затем обратно транскрибируется в ДНК и встраивается на новое место в геноме. Часть этой молекулы РНК, как правило, бывает двухцепочечной и при необходимости может быть узнана механизмом РНК-интерференции. Таким образом, интерферирующие РНК защищают геном от транспозонов, то есть от части его самого.
Сотни генов в нашем геноме кодируют небольшие молекулы РНК, называемые микроРНК. Они содержат фрагменты кода других генов. Такая микроРНК может образовывать двухцепочечную структуру и активировать механизмы интерференции РНК для блокирования синтеза соответствующего белка. Теперь мы понимаем, что генетическая регуляция микроРНК играет важную роль в развитии организма, для здоровья которого крайне важно, чтобы в нужное время синтезировались нужные белки.
РНК-интерференция открывает огромные возможности для использования в генной инженерии. Были разработаны специальные двухцепочечные молекулы РНК для искусственного подавления определенных генов у людей, животных или растений. Такие молекулы РНК вводятся в клетку и так же, как в природе, активируют механизм РНК-интерференции для разрушения мРНК с идентичным кодом.
Этот метод уже стал важным инструментом исследователей в биологии и биомедицине. В будущем ожидается, что он будет использоваться во многих областях, включая клиническую медицину и сельское хозяйство. Например, во время опытов с животными было показано, что гены, вызывающие высокий уровень холестерина в крови, можно искусственно подавить, если ввести интерферирующую РНК. В настоящее время ученые разрабатывают планы по лечению с помощью РНК-интерференции вирусных инфекций, сердечно-сосудистых заболеваний, рака, эндокринных расстройств и так далее.
Теломера, преодолевшая предел Хейфлика
Элизабет Блэкберн
Джек Шостак
Кэрол Грейдер

В 2009-м Нобелевскую премию по физиологии и медицине присудили трем ученым, которые экспериментальным путем смогли решить фундаментальную задачу биологии. Вот ее суть: как предотвратить укорочение хромосом при каждом последующем делении клеток, как копировать клетки неизмененными и таким образом продлевать жизнь организма и отодвигать старение. Американские цитогенетики Элизабет Блэкберн, Джек Шостак, а также биолог Кэрол Грейдер продемонстрировали ее решение: оно находится в концевых участках хромосом — теломерах. Ученые выделили фермент теломеразу, который препятствует укорочению хромосом.

