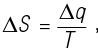
отражающую термодинамические процессы, которые мы наблюдали ранее.
Во времена Больцмана идея, что вещество состоит из малых невидимых частиц, которые сегодня мы называем атомами, еще не была главенствующей. Нетрудно представить, что теории Больцмана, предполагавшие их существование, могли встретиться с некоторым сопротивлением. Больцмана жестко критиковали, но он отказывался отступать. В 1898 году Больцман опубликовал второй том «Лекций по теории газа». Так что мы можем получить представление, насколько стойко он был убежден в существовании атомов:
«По-моему, это была бы большая трагедия для науки, если бы [кинетическая] теория газов была предана забвению из-за сиюминутного враждебного отношения… Я понимаю, что я всего лишь отдельный человек, бессильно сражающийся с духом времени. И все равно в моих силах сделать такой вклад, что, когда [кинетическую] теорию газов возродят к жизни, заново придется открывать не так уж много».
Среди самых ярых противников Больцмана был Фридрих Вильгельм Оствальд (1853–1932). Он был противником всех теорий химии и физики, которые подразумевали существование атомов, особенно кинетической теории газов. Для Оствальда объединяющей научной концепцией была энергия. Он считал энтропию распадом энергии (что было близко к концепции Томсона), не имевшим ничего общего с движением атомов и микросостоянием систем. Оствальд считал атомы артефактами математической теории, а не проявлениями физической реальности.
Другой противник атомной теории Эрнст Мах (1838–1916) не подписался бы и под объединяющим концептом энергии, который защищал Оствальд. Мах просто не мог принять идею существования атомов, потому что не видел доказательств в пользу их существования. С оглядкой на микроскопическую интерпретацию энтропии у Больцмана Мах писал: «По моему мнению, корни этой теоремы [об энтропии] лежат гораздо глубже, и если привести в соответствие молекулярную [атомную] гипотезу и теорему об энтропии, это было бы удачей для гипотезы, но не для теоремы об энтропии».
Летом 1905 года Больцман читал серию лекций в Калифорнийском университете в Беркли. Он был на пике славы. Студенты стремились попасть на его лекции, а коллеги искали его научного совета. По возвращении в Вену (не имея понятия о работе Эйнштейна 1905 года) Больцман описал свое путешествие в книге «Путешествие одного немецкого профессора в Эльдорадо»
.
В начале 1906 года Больцман был в отпуске со своей женой и дочерью недалеко от побережья итальянского города Триест. В очередной раз борясь с депрессией, Больцман повесился на оконной раме, пока женщины были на пляже. Вернувшись, его дочь обнаружила его мертвым. Людвиг Больцман похоронен на Центральном кладбище его родного города Вены. На его могильной плите написано выражение для энтропии через число микросостояний системы:
S = k ln W,
где S – это полная энергия системы, k – постоянная Больцмана
, а W – общее число микросостояний, соответствующих данному макросостоянию системы.
За гранью тепловых двигателей
Когда мы говорим об энтропии, мы рассматриваем два взаимодополняющих варианта ее истолкования: термодинамику и статистическую механику. Первоначальное описание энтропии было чисто термодинамическим и пришло из работ Клаузиуса. Он обнаружил, что при работе обратимого теплового двигателя Карно возникает очень интересная величина: «отношение тепла к температуре». Спустя одиннадцать лет он стал называть эту удивительную величину энтропией. Главным результатом наблюдений Клаузиуса стало понимание того, что в необратимых процессах всегда растет уровень энтропии.
Нас интересуют необратимые процессы, поскольку мы каждый день сталкиваемся с ними. Они необратимы без совершения какой-либо определенной работы. Упавший на пол и разбившийся стакан – необратимый процесс: в этом случае из-за того, что он разбился, выросла энтропия, и стакан не станет вдруг целым без приложения работы с нашей стороны – например, склеивания осколков – и даже если вы его склеите, не вернется в первоначальное состояние. Более того, стакан был разбит спонтанно
. Это значит, что, кроме небольшой работы, которая понадобилась, чтобы привести его в движение (вероятно, столкнуть с кухонного стола), весь процесс полностью прошел без вашего участия. Таким образом, мы видим, что растущая энтропия отображает «предпочтительное направление» процессов, протекающих в природе. Если мы видим разбитое стекло, то мы все понимаем, что в какой-то момент прошлого оно было целым. Иными словами, в некий момент энтропия стекла была меньше, чем сейчас. Следовательно, похоже, что энтропия связана со временем, или со стрелой времени.
Первое начало сообщает нам, что энергия всегда сохраняется, просто переходит из одной формы в другую, а второе начало говорит, что энтропия не сохраняется, но стремится к максимуму. В самом деле, похоже, что природа постоянно порождает энтропию. Неважно, насколько эффективно какое-либо устройство – оно тоже будет создавать энтропию. Это закон природы.
Когда вы едете на машине, двигатель выделяет тепло в окружающую среду, потому что этого требуют законы природы (это компенсация, которую требует природа за то, что вы пользуетесь автомобилем). Поэтому невозможно использовать абсолютно все топливо (энергию) для работы. Более того, будет возникать дополнительная потеря тепла из-за разного рода трений внутри двигателя вашего автомобиля. И поскольку, согласно Клаузиусу, энтропия – это «отношение тепла к температуре», природа снова нашла способ приблизить ее значение к максимуму.
Хотя определение энтропии у Клаузиуса достаточно точное, оно не является полным. Клаузиус пытался объяснить энтропию с точки зрения микроскопических частиц, молекул и атомов, но его попытки были безуспешными. Максвелл же сделал первые шаги в этом направлении. Он продемонстрировал, что атомы газа двигаются на разных скоростях, ограниченных определенным диапазоном, или распределением. По сути, скорость атомов в этом диапазоне такова, что малое их количество перемещается быстрее или медленнее основной массы, которая движется со средней скоростью. Это был первый случай, когда статистический подход использовали для описания физических свойств системы. Более того, он избавлял от устрашающей и со всех практических точек зрения невыполнимой задачи учитывать все столкновения внутри системы атомов газа.
Ранее мы говорили, что при комнатной температуре и давлении шар, наполненный гелием, содержит приблизительно 1023
атомов, которые двигаются со средней скоростью около 4 500 км/ч, при этом отдельный атом сталкивается миллиарды раз в секунду с другими атомами. Как вообще можно надеяться точно учесть все это?
Максвелл продемонстрировал, что это и не нужно, таким образом открыв дорогу Больцману. Тот показал, что подход Максвелла применим не только к скорости атомов или их кинетической энергии, но и к общей энергии системы в распределении Больцмана. Это решение стало революционным.

