Вторичная структура белка представляет собой упорядоченное свертывание полипептидной цепи в спираль, которая имеет вид растянутой пружины. Витки спирали укрепляются водородными связями,
[32] возникающими между карбоксильными группами (СО-) и аминогруппами (NH-).
Водородные связи слабые, но, многократно повторяясь, они придают спирали белковой молекулы устойчивость и жесткость. На уровне вторичной структуры существуют такие белки, как, например, коллаген (сухожилия) или кератин (волосы, ногти).
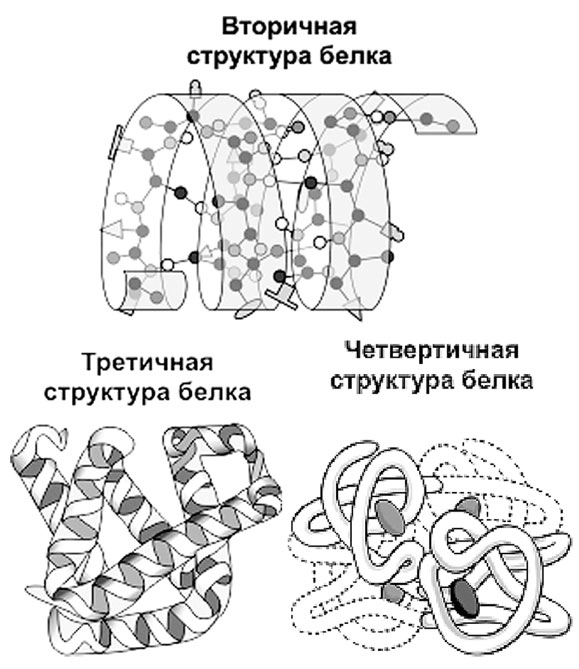
Третичная структура белка представляет собой укладку полипептидных цепей в «клубки» – глобулы, возникающая в результате возникновения различных химических связей.
На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами, соединенными какими-то химическими связями. Наиболее известным белком, имеющим четвертичную структуру, является белок крови гемоглобин, молекула которого образована четырьмя «клубками». Клубки связывает вместе общее для всех железосодержащее «ядро», называемое гемом. «Гема» в переводе с греческого означает «кровь», «глобус» – это «шар» на латыни. Гемоглобин – кровяной шар.
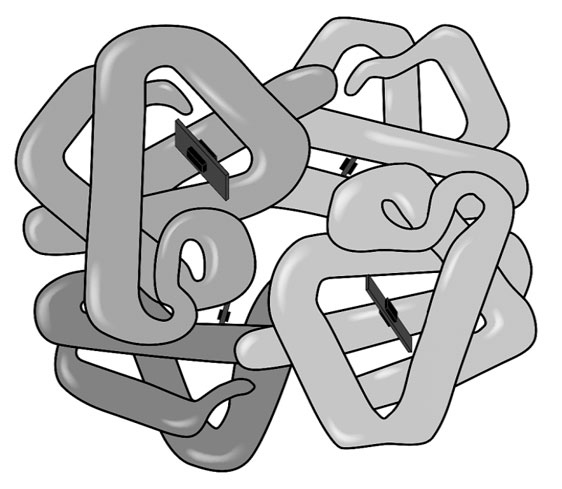
Молекула гемоглобина
Что случается с белком куриного или какого-то другого птичьего яйца при нагревании? Он сначала начинает загустевать, а затем твердеет, потому что тепловая энергия вызывает разрыв связей, удерживающих молекулу белка в свернутом виде. Молекула «расправляет плечи». Сначала утрачивается четвертичная структура, затем – третичная, затем – вторичная и молекула белка становится нитевидной. Нитевидной молекуле расправляться больше некуда, но она может распасться на несколько составных частей.
Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией (денатурация – потеря природной структуры). Изменение пространственной конфигурации молекулы приводит к изменению ее свойств и делает невозможным выполнение присущих ей биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой – ниточка снова свернется в клубочек и займется своим делом. Процесс восстановления структуры белка после денатурации называется ренатурацией.
Белки участвуют во всех процессах жизнедеятельности клетки и выполняют в организме различные функции. Биологические функции белков более разнообразны, чем функции других полимеров – полисахаридов и ДНК. Всех функций белков мы касаться не будем, отметим только самые важные.
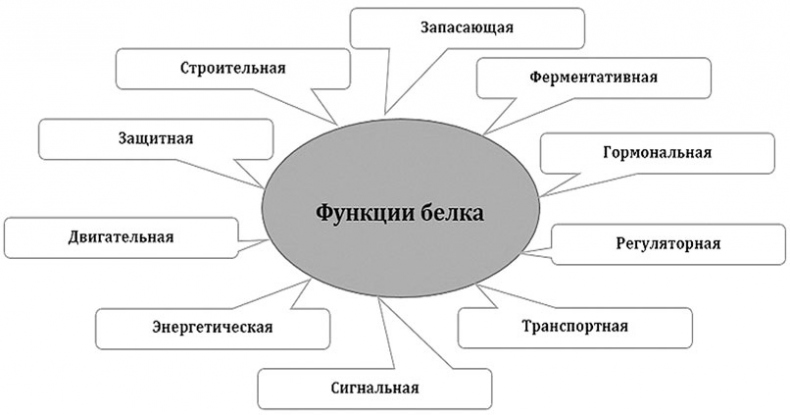
Функции белков
Строительная функция белков заключается в том, что они участвуют в образовании клеточных и внеклеточных структур.
Белки, входящие в состав клеточных мембран выполняют транспортную и рецепторную функции. Они обеспечивают избирательный перенос веществ и ионов через белковые каналы и воспринимают идущие извне сигналы, а также играют роль «визитных карточек», то есть служат для распознавания клеток. Важнейшую роль в организме играет белок гемоглобин, который занимается транспортировкой веществ в глобальном масштабе – в легких присоединяет кислород и доставляет его ко всем тканям и органам, а обратно в легкие переносит углекислый газ.
Особые белки, называемые ферментами, активизируют химические реакции, которые происходят в клетках.
Белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных.
В регуляции обменных процессов принимают участие белки-гормоны. Так, например, белок инсулин регулирует содержание глюкозы в крови и не только.
В ответ на проникновение в организм чужеродных агентов, образуются особые белки, называемые антителами, которые связываются с этими агентами и тем самым обезвреживают их.
Белок фибрин, образующийся из белка фибриногена, способствует прекращению кровотечений. В месте повреждения кровеносного сосуда образуется фибриновая сеть. В этой сети застревают кровяные клетки о образуется пробка, закупоривающая поврежденное место.
Белки могут служить запасом питательных веществ. Чаще всего это происходит в структурах, связанных с размножением, например – в семенах многих растений, в яйцах животных, в икре рыб. Расщепляя белки из запаса, растущий организм получает аминокислоты, необходимые для синтеза собственных белков, а также получает энергию, расщепляя аминокислоты до конечных продуктов – воды, углекислого газа и аммиака. Но вообще-то расщеплять аминокислоты для получения энергии – это расточительство. Выгоднее использовать аминокислоты в качестве строительного материала для выработки белков. Поэтому в организмах животных белки используются в качестве источника энергии только после того, как будут израсходованы другие источники – углеводы (гликоген, глюкоза) и жиры.
О липидах мы уже говорили, когда знакомились со строением клеточных мембран. Давайте повторим, что к этой группе органических соединений относятся жиры и жироподобные вещества.
Липиды подразделяют на простые и сложные.
Простые липиды в большинстве своем представлены триглицеридами – сложными эфирами высших жирных кислот и трехатомного спирта глицерина.
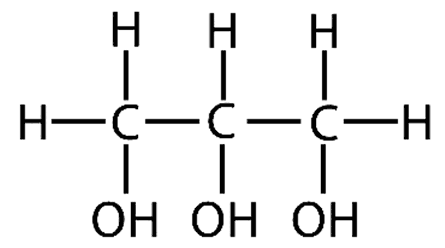
Глицерин
Вы могли подумать, что глицерин называют «трехатомным спиртом» потому что его молекула образована тремя атомами углерода. Нет! На самом деле речь идет от трех гидроксильных группах (-ОН), такие вот химические тонкости.






