Сравнивания РНК-последовательности от разных видов, Гарри с Карлом Вёзе смогли выяснить их соотношение и принцип получения пар оснований. В рибосомной РНК много сегментов, имеющих форму двойной спирали. Вёзе пришел к выводу, что, кроме бактерий и эукариот, существует третий самостоятельный домен живых организмов – археи. Сегодня считается, что примитивные бактерии скрестились с древними археями и породили первые эукариоты (организмы, в клетках которых есть ядро). Археи, как и бактерии, являются прокариотами, то есть не имеют клеточного ядра. Затем из эукариот развились сложные многоклеточные организмы, в том числе люди.
После того как была отсеквенирована рибосомная РНК, Гарри решил определить место воздействия на молекулу химических агентов, изменявших ее. Он приспособил для этого метод, ранее разработанный для проверки места связи белков с ДНК, который состоял в обработке ДНК химическим реагентом до и после того, как с ней свяжется белок. Белок защищал те участки ДНК, с которыми связывался, и добавление реагента позволяло их измерить. Гарри и его студенты, среди которых следует особо отметить Данеша Моазеда, стали применять этот метод, именуемый футпринтингом, изучая рибосомную РНК. Они определили, какие ее участки связываются с молекулами тРНК и рибосомными белками. Но оставалось неясным, зачем части рибосомы соприкасаются друг с другом.
Футпринтинг с использованием антибиотиков оказался более интересен. Некоторые модифицированные белки обеспечивают резистентность рибосом к антибиотикам, но никому не удавалось «заставить» антибиотики напрямую связываться с рибосомными белками. При помощи футпринтинга Гарри доказал, что каждый антибиотик связывается с конкретным участком рибосомной РНК. Поскольку антибиотики блокируют работу рибосом, очевидно, что у рибосомной РНК должна быть некая важная функция. Так вся дисциплина была переориентирована на определение роли рибосомной РНК.
После длительного забвения рибосомы вновь вызвали интерес. Питер Мур в статье «Рибосома возвращается», опубликованной в Nature в 1988 году, писал: «Мода в биохимии изменчива. Открытие, показавшее, что некоторые РНК действуют как ферменты, оживило интерес к рибосомам, которыми долго пренебрегали»
[14]. Но даже он не мог предположить, каким ярким станет возвращение рибосомы.
В 1992 году, к концу моего творческого отпуска, статья Гарри в Science пользовалась большой популярностью. Он пытался ответить на вопрос, что, кроме РНК-составляющей рибосомы, обладает способностью обеспечивать ключевую биохимическую реакцию синтеза полипептида (объединения двух аминокислот, между которыми образуется пептидная связь). Иными словами, является ли рибосома рибозимом? Он взял субъединицы 50S у бактерий Thermus, обитающих в гейзерах Йеллоустонского национального парка, и обработал их ферментом, переваривающим белки и разделяющим их на фрагменты. Затем он извлек максимум уцелевших белковых фрагментов. Полученные в результате субъединицы почти полностью состояли из РНК, но тем не менее могли поддерживать химическую реакцию.
Статья Гарри подняла большую шумиху в широком научном сообществе, но в целом этот результат не особо удивил тех, кто давно занимался рибосомами. Кроме того, он был не окончательным. Гарри изрядно потрудился, чтобы очистить субъединицу 50S от белков, однако в ней все равно оставалось немало белковых фрагментов, которые могли отвечать за реакцию. Когда Гарри применил иной метод, на этот раз полностью удалив все белки, частицы стали неактивны. Эта процедура не работала с рибосомами от E. coli, а именно с этой бактерией работало большинство специалистов. Сам Гарри исподволь признавал недостатки своей работы, озаглавив статью о ней весьма осторожно: «Необычная резистентность пептидил-трансферазы при процедурах извлечения белков». Несколько лет спустя (в 1998 году) группа японских специалистов, казалось, достигла цели, когда им удалось получить фрагменты чистой рибосомной РНК, способные поддерживать такую реакцию. Но после публикации результатов этого исследования в Science (опять же, с большой помпой) они обнаружили изъяны в своей работе и год спустя отозвали статью.
Было ясно, что по итогам сорокалетнего труда по разгадке секретов рибосомы одними лишь химическими методами ничего не оставалось, кроме как попробовать другие методы. В той самой статье, где Крик предположил, что первые рибосомы могли целиком состоять из РНК, он также отмечал: «Без более полного представления о структуре современных рибосом сложно высказать обоснованное предположение»
[15].
Глава 7
Рубеж преодолен
Кроме статьи Гарри Ноллера из Science, мое внимание в период творческого отпуска привлекла и другая краткая заметка 1991 года: Ада Йонат сообщала, что ей удалось коренным образом улучшить кристаллы большой субъединицы. Впервые кристаллы вышли настолько качественными, чтобы на их основе можно было полностью определить атомную структуру целой рибосомной субъединицы, содержащей сотни тысяч атомов. Рубеж был пройден. Здесь необходимо пояснить, в каком случае кристалл можно считать достаточно качественным.
До сих пор мы опирались на то, что кристаллы образуются из молекул, укладывающихся ровными рядами в трехмерную структуру, именуемую кристаллической решеткой. Если молекула большая и гибкая, как белковая, то при кристаллизации она не примет в решетке ровно такую же ориентацию, что и соседствующие с ней молекулы. Итоговое изображение – это результат совокупного вклада миллионов отдельных молекул, образующих кристалл. Если все молекулы в кристалле расположены по-разному, то вклад каждой из них неясен. Для сравнения: представьте себе, как будут отличаться многократные фотографические экспозиции неподвижного и движущегося объектов.
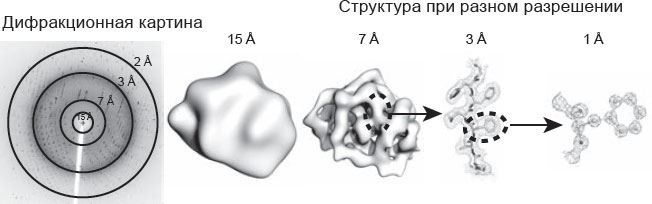
Рис. 7.1. Дифракция и детализация, фиксируемая при разном разрешении
Качество кристалла зависит не от того, насколько аккуратно он выглядит, а от того, насколько хорошо он рассеивает рентгеновские лучи. Как я упомянул в главе 3, разрешение позволяет судить, насколько близко расположены два участка, которые не наслаиваются друг на друга. На практике о качестве разрешения кристалла можно судить, рассмотрев, насколько велика градусная мера угла, на которую распространяются в стороны от входящего пучка пятна рентгеновской дифракции.
Плохой кристалл дает всего несколько дифракционных пятен по бокам от основного рентгеновского пучка, позволяющих составить лишь общие представления о его форме. В более качественных кристаллах, обеспечивающих разрешение 5–7 ангстрем, можно рассмотреть некоторые черты белков (одноцепочечные альфа-спирали в виде трубочек), ДНК и РНК (бороздки в спиралях). В кристаллах с хорошей дифракцией пятна видны под очень широкими углами, вплоть до теоретического предела, связанного с длиной волны рентгеновского излучения. (Как вы помните, невозможно рассмотреть детали, удаленные друг от друга менее чем на половину длины волны.) На данном пределе у простых молекул, например солей, просматриваются отдельные атомы, напоминающие шарики. Но для белков практически никогда не удается достичь разрешения в 1 ангстрем, возможного для молекул. А по мере того как молекулы становятся все крупнее и гибче, они редко приобретают при кристаллизации форму, обеспечивающую высокое разрешение при дифракции: чем больше угол охвата, тем более размытыми становятся дифракционные пятна, пока, наконец, совсем не исчезают. Соответственно, чем больше угол, в рамках которого просматриваются дифракционные пятна, тем выше разрешение структуры. В среде специалистов принято говорить и о разрешении кристалла, и даже о разрешении конкретного дифракционного пятна.



